Inicio / Archivo / Año 6, No 6, septiembre 2023 - agosto 2024 / Paper 13

NANOPARTÍCULAS DE PLGA y PLGA-PEG CON CURCUMINA Y SU EFECTO SOBRE AFLATOXINA B1 IN VITRO
Roberto Díaz-Torres1, Jesús Abraham Méndez-Albores2* y Patricia Ramírez-Noguera1
1Unidad de Investigación Multidisciplinaria, Laboratorio 9, Facultad de Estudios Superiores Cuautitlán, Universidad Nacional Autónoma de México.
2Unidad de Investigación Multidisciplinaria, Laboratorio 14, Facultad de Estudios Superiores Cuautitlán, Universidad Nacional Autónoma de México.
*diaztorres_r@cuautitlan.unam.mx
Resumen
La aflatoxina B1 (AfB1) es una potente micotoxina hepatocarcinogénica. Las principales manifestaciones de toxicidad inducida por la aflatoxina B1 relacionadas con el estrés oxidante son peroxidación lipídica y daño oxidativo del ADN que podría ser contrarrestada por antioxidantes. El objetivo de este estudio fue evaluar el efecto de nanopartículas preparadas con ácido poliláctico-co-glicólico (PLGA) y PLGA con polietilenglicol (PLGA-PEG) cargadas con curcumina en hepatocitos humanos expuestos a la aflatoxina B1 in vitro. Se realizó la caracterización de las nanopartículas en cuanto a tamaño y potencial zeta. Se estimaron algunos biomarcadores asociados al estrés oxidante, como viabilidad y cantidad de glutatión intracelular. Los resultados mostraron un aumento en la concentración de GSH en células expuestas a nanopartículas de PLGA y PLGA-PEG con curcumina. Estos resultados sugieren que las nanopartículas cargadas con curcumina pueden modular efectos celulares asociados con el estrés oxidante in vitro.
Palabras clave:Micotoxinas, Estrés oxidante, Nanoestructuras, Antioxidante, Hepatocarcinógenos.
Introducción
Las aflatoxinas son metabolitos tóxicos producidos para los alimentos durante el crecimiento de los grupos fúngicos Aspergillus flavus y Aspergillus parasiticus (El-Agamy, 2010; Wang et al., 2013). La aflatoxina B1 es una potente micotoxina hepatotóxica y hepatocarcinogénica. La peroxidación lipídica y el daño oxidativo del ADN son las principales manifestaciones de toxicidad. Muchos derivados de plantas, como la curcumina, se han estudiado como protectores contra el daño hepático asociado con la peroxidación lipídica inducida por la aflatoxina B1 (Wang et al., 2013). Desafortunadamente, se ha demostrado que la baja solubilidad acuosa y la biodisponibilidad oral limitada de la curcumina son obstáculos importantes en su desarrollo como agente terapéutico (Shaikh et al., 2009).
Los nuevos sistemas de administración de fármacos han tenido un gran impacto en la tecnología médica (Bala et al., 2004). Para una liberación eficaz del fármaco, el rango de tamaño de las nanopartículas es fundamental, ya que puede facilitar el aumento de la captación celular del fármaco dirigido a las células diana. Lo que a su vez mejora la biodisponibilidad de los compuestos terapéuticos (Semete et al., 2010). El ácido poliláctico-co-glicólico (PLGA) es parte de una familia de polímeros biodegradables aprobados por la FDA que son altamente biocompatibles y han sido ampliamente estudiados como vehículos de administración de fármacos, proteínas y otras macromoléculas como ADN, ARN y péptidos (Bedard & Massey, 2006; El-Agamy, 2010; Shaikh et al., 2009).
El PLGA es un copolímero de ácido poliláctico (PLA) y ácido poliglicólico (PGA). Es el biomaterial mejor definido disponible para la administración de fármacos con respecto al diseño y el rendimiento (Makadia & Siegel, 2011). Sin embargo, la necesidad de mejores formulaciones que incorporen una variedad de fármacos y métodos de administración ha resultado en el desarrollo de varios tipos de copolímeros en bloque con polietilenglicol (PEG). Esta capa de PEG sirve como barrera y reduce las interacciones con moléculas extrañas por repulsión estérica, lo que conduce a una mayor estabilidad de almacenamiento.
La curcumina, como se dijo anteriormente, es muy poco soluble, lo que limita mucho su biodisponibilidad. En este trabajo queremos evaluar la efectividad de sistemas nanoparticulados a base de PLGA y PLGA-PEG y su capacidad hepatoprotectora.
Objetivo
Evaluar el efecto hepatoprotector de las nanopartículas de PLGA y PLGA-PEG cargadas con curcumina en un modelo in vitro, usando células HepG2.
Materiales y métodos
Preparación de Nanopartículas de PLGA y PLGA-PEG cargadas con Curcumina.
La preparación de las nanopartículas de PLGA y PLGA-PEG cargadas con curcumina se realizó mediante la técnica denominada nanoprecipitación. Se disolvieron 75 mg de PLGA o PLGA-PEG y 3.8 mg de curcumina en 10 mL de acetona, la solución se añadió gota a gota a una solución de 20 mL de PVA (Alcohol polivinílico) al 1% bajo agitación; se mantuvo la agitación durante 10 min. Posteriormente, el disolvente orgánico (acetona) se evapora en un evaporador rotatorio a 40 °C y 40 rpm. La suspensión resultante se centrifugó, preparando un sistema que contenía 5 mL de glicerol, 20 mL de la suspensión de nanopartículas y 10 mL de agua desionizada, se ultra centrifugó el sistema a 29786 g durante 1 h (Optima XL-100K Ultracentrifuge, rotor SW-28, Beckman Coulter, Brea, California, USA), se eliminó el sobrenadante, recolectando 5mL cerca de la interfase y fueron almacenados a 4°C protegidos de la luz.
Determinación de la eficiencia de encapsulación.
La determinación de curcumina encapsulada se realizó por espectrofotometría, realizando previamente una curva de calibración. Para determinar la eficiencia de encapsulación se colocaron 2 mL de suspensión de nanopartículas (tanto PLGA como PLGA-PEG cargadas con curcumina) en viales a peso constante y se colocaron en estufa a 60 °C por 24 h para permitir la evaporación del agua, posteriormente el sólido resultante se pesó y se suspendió en 2 mL de acetonitrilo. El sistema se agitó suavemente durante 4 h para permitir que la curcumina se difundiera en el solvente, finalmente se centrifugó a 11357 g por 20 min (Microfuge 22R Centrifuge, Beckman Coulter, Brea, California, USA), se removió el sobrenadante y se diluyó 1:5 con etanol (80%) y se realizó la estimación por espectrofotometría.
La eficiencia de encapsulación se calculó mediante la siguiente ecuación:

Caracterización de Nanopartículas
La caracterización del tamaño de partícula y el potencial zeta se realizaron mediante dispersión de luz dinámica y electroforesis láser Doppler, respectivamente, en el dispositivo Zetasizer Nano-ZS90, Malvern Instruments (Worcestershire, West Midlands, United Kingdom).
Modelo Experimental
Para determinar el efecto hepatoprotector de las nanopartículas de curcumina contra la intoxicación inducida por AfB1, se utilizó como modelo la línea celular HepG2 (Liu et al., 2011; Luo et al., 2014).
Cultivo celular y esquema de exposición.
Las células se mantuvieron en medio de cultivo Dulbecco's Modified Eagle Medium (DMEM) suplementado con 10% de suero bovino fetal y 2% de antibiótico a 37 °C y 5% de CO2. La curcumina se disolvió en dimetilsulfóxido (DMSO) y luego se diluyó con medio de cultivo para ajustar las concentraciones deseadas, la concentración final de DMSO en cultivo no fue mayor al 0.1%, así mismo los controles con 0.1%.
Se incluyeron DMSO en todos los experimentos. Las células se sembraron en placas de 24 pocillos hasta la confluencia. Inicialmente, se realizó exposición a AfB1 (25 M) por 4 h, luego se realizó una segunda exposición con curcumina libre o encapsulada a diferentes concentraciones por 4 h.
Viabilidad celular (MTT)
Dos horas antes de la finalización del tiempo de exposición descrito anteriormente, se añadieron 5 mL de reactivo MTT en una concentración de 5 mg mL-1. Transcurrido el tiempo de exposición, se retiró el medio de cultivo y se añadieron 0.3 mL de un tampón nonidet en isopropanol y se dejó en suave agitación durante 20 min. Finalmente, se eliminó la solución y la viabilidad es determinada por espectrofotometría en lector de placas Elisa (MRC Scientific Instruments, Essex, UK).
Determinación de glutatión reducido (GSH)
Una vez finalizado el tiempo de exposición, se retira el medio de cultivo de los pocillos, se lava 2 veces con PBS (Phosphate buffer Solution, Solución amortiguadora de fosfato) frío y se recolectan las células por raspado. La suspensión celular se centrifugó a 9660 g durante 10 min a 4 °C, luego se eliminó el sobrenadante y se resuspendió el botón en PBS con inhibidor de proteasa. La suspensión se sonica y se toman 10 L de esta suspensión para la determinación de proteínas. A la suspensión restante se le agregan 5 L de ácido sulfosalicílico (5%) y se incuba a temperatura ambiente por 10 min, finalmente se centrifuga a 9660 g por 10 min a 4 °C y se recupera el sobrenadante. De esta solución se tomaron 50 L y se colocaron en un pocillo de una microplaca de 96 pocillos, finalmente se adicionaron 150 L de tampón de reacción y se cuantificó el GSH en la muestra en lector de placas Elisa a λ = 412 nm.
Análisis estadístico.
Los datos se presentan con el error estándar de la media (SEM) analizados mediante ANOVA de una vía. Todos los experimentos se realizaron al menos 6 veces de forma independiente.
Resultados y discusión
La Tabla 1 muestra los resultados obtenidos para nanopartículas cargadas de curcumina de PLGA y PLGA-PEG, nótese que las nanopartículas de PLGA, a pesar de tener un tamaño mayor, tienen un porcentaje de encapsulación menor.
Caracterización de Nanopartículas de Curcumina.
Tabla 1. Resultados del desarrollo de nanopartículas de Curcumina de PLGA y PLGA-PEG.
| Polimero | Eficiencia de Encapsulación (%) | Tamaño de partícula (nm) | PDI | Potencial Zeta (mV) |
|---|---|---|---|---|
| PLGA | 22.26 | 261.2 | 0.095 | -1.46 |
| PLGA-PEG | 64.46 | 104 | 0.171 | -1.625 |
Esta eficiencia de encapsulación de PLGA se puede atribuir a varios factores. Primero, tanto el PLGA como el PLGA-PEG tienen naturaleza hidrofóbica, por esa razón, les resulta fácil atrapar la curcumina hidrofóbica. En segundo lugar, la naturaleza hidrofóbica de la curcumina, que resulta en una migración mínima del fármaco a la fase acuosa externa, durante el proceso de formación de nanopartículas (Ranjan et al., 2012).
En las nanopartículas de PLGA-PEG, las cadenas de PEG están orientadas hacia la fase acuosa externa, envolviendo el complejo PLGA-curcumina. Esta capa de PEG sirve como barrera y reduce las interacciones con moléculas extrañas por repulsión estérica además de darle una propiedad hidrófila, por lo que las cadenas de PEG proporcionan mayor estabilidad, reduciendo la interacción y evitando la migración de la curcumina hacia el exterior, dando mayor estabilidad de carga (Makadia & Siegel, 2011).
Viabilidad celular (MTT)
La Figura 1 muestra los resultados de la exposición de células HepG2 frente a una concentración de 25 M de AfB1 durante 4 h, y la posterior exposición a curcumina libre y nanopartículas de curcumina a concentraciones de 0.2, 2, 5 y 10 M. Estos resultados mostraron una viabilidad superior al 100% en ambas Nanopartículas de Curcumina (PLGA y PLGA-PEG).
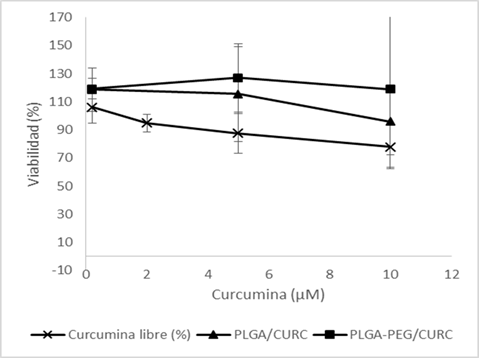
Figura 1. Viabilidad de la línea celular HepG2 posterior a la exposición por 4 h de curcumina libre y NP-CURC a diferentes concentraciones (0.2, 2, 5 y 10 µM).
La Figura 1 muestra las medias de los tratamientos estudiados, lo que demuestra que hubo diferencias significativas entre los valores de viabilidad celular de los tratamientos de curcumina libre y los tratamientos con Curcumina. En nanopartículas, tanto para PLGA como para PLGA-PEG, se notan diferencias que comienzan en 0.2 M, aumentando la viabilidad celular, incluso en el tratamiento con concentraciones importantes de curcumina libre.
Estos resultados muestran claramente el efecto hepatoprotector de la curcumina contra la intoxicación por micotoxinas. Sin embargo, debido a que la disminución en la viabilidad celular generada por la curcumina libre y AfB1 son procesos totalmente diferentes, como se mencionó anteriormente, la curcumina puede cambiar la morfología de la superficie celular y conducir a un proceso proapoptótico, este proceso depende de la dosis (Choudhuri et al., 2005; Wang et al., 2011); por el contrario, en el proceso de citotoxicidad de las aflatoxinas, el estrés oxidativo es el principal efecto tóxico (El-Agamy, 2010), por lo que se necesitan más estudios para definir con mayor precisión el efecto hepatoprotector de la curcumina sobre la intoxicación por AfB1.
Determinación de glutatión reducido (GSH)
En la Figura 2 se muestran los resultados para la cuantificación de GSH en células HepG2. Aunque no se observa diferencia estadísticamente significativa entre tratamientos, excepto entre la curcumina libre a una concentración de 2 M y 20 M y las Nanopartículas de Curcumina de PLGA a 2 M y 20 M en comparación con el control, en la Figura 2 observamos una tendencia en la que la cantidad de GSH presente en la muestra aumenta significativamente cuando aumenta la concentración de curcumina libre y curcumina encapsulada en nanopartículas de PLGA y PLGA-PEG, en concentraciones de 0.2, 2 y 20 M.
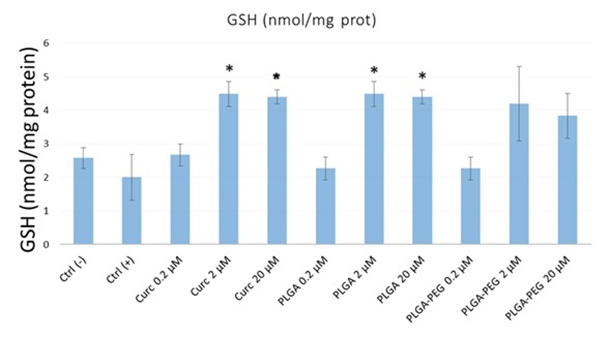
Figura 2. Cuantificación de GSH en células HepG2 con exposición a NP-CURC por 4h, posterior a una exposición con AFB1 25 µM. * Representan una diferencia estadísticamente (P<0.05) significativa con respecto al control negativo.
Esto es consistente con estudios previos de Pou Kuan Leong y colaboradores (Leong et al., 2012). Donde se realizó la exposición de células AML12 a curcumina, encontrándose un aumento en los niveles de GSH, aunado a una disminución en la peroxidación lipídica. El mayor efecto de la curcumina sobre la estimulación de la producción de GSH puede estar relacionado con su capacidad para inducir directamente la disociación de la proteína Keap 1, un represor Nrf2, con una modulación antioxidante (Leong et al., 2012).
Conclusión
Se prepararon nanopartículas de PLGA y PLGA-PEG cargadas con curcumina, obteniendo mejores resultados en cuanto a tamaño de partícula y carga de curcumina con el polímero PLGA-PEG. El ensayo de viabilidad celular mostró que la curcumina encapsulada tiene un mejor efecto protector contra la intoxicación por AfB1 que la curcumina libre, mostrando una mayor concentración intracelular de GSH, teniendo tendencia a aumentar el GSH en células tratadas con Nanopartículas de Curcumina. Con base en estos resultados, podemos decir que las Nanopartículas de Curcumina preparadas con PLGA y PLGA-PEG tienen potencial como tratamiento para la intoxicación por AfB1.
Agradecimientos
Este trabajo fue apoyado por UNAM-PAPIIT IN214321 (Universidad Nacional Autónoma de México (UNAM)); Facultad de Estudios Superiores Cuautitlán, UNAM, Cátedra de Investigación: CI2225.
Referencias
Bala, I., Hariharan, S., & Kumar, M. N. (2004). PLGA nanoparticles in drug delivery: the state of the art. Crit Rev Ther Drug Carrier Syst, 21(5), 387-422. https://doi.org/10.1615/critrevtherdrugcarriersyst.v21.i5.20
Bedard, L. L., & Massey, T. E. (2006). Aflatoxin B1-induced DNA damage and its repair. Cancer Lett, 241(2), 174-183. https://doi.org/10.1016/j.canlet.2005.11.018
Choudhuri, T., Pal, S., Das, T., & Sa, G. (2005). Curcumin selectively induces apoptosis in deregulated cyclin D1-expressed cells at G2 phase of cell cycle in a p53-dependent manner. Journal of Biological Chemistry, 280(20), 20059-20068.
El-Agamy, D. S. (2010). Comparative effects of curcumin and resveratrol on aflatoxin B(1)-induced liver injury in rats. Arch Toxicol, 84(5), 389-396. https://doi.org/10.1007/s00204-010-0511-2
Leong, P. K., Chiu, P. Y., & Ko, K. M. (2012). Prooxidant-induced glutathione antioxidant response in vitro and in vivo: a comparative study between schisandrin B and curcumin. Biological and Pharmaceutical Bulletin, 35(4), 464-472.
Liu, R., Chang, M., Jin, Q., Huang, J., Liu, Y., & Wang, X. (2011). Degradation of aflatoxin B 1 in aqueous medium through UV irradiation. European Food Research and Technology, 233, 1007-1012.
Luo, X. H., Wang, R., Wang, L., Li, Y. F., Bian, Y. Y., & Chen, Z. X. (2014). Effect of ozone treatment on aflatoxin B-1 and safety evaluation of ozonized corn. Food Control, 37, 171-176. https://doi.org/10.1016/j.foodcont.2013.09.043
Makadia, H. K., & Siegel, S. J. (2011). Poly Lactic-co-Glycolic Acid (PLGA) as Biodegradable Controlled Drug Delivery Carrier. Polymers (Basel), 3(3), 1377-1397. https://doi.org/10.3390/polym3031377
Ranjan, A. P., Mukerjee, A., Helson, L., & Vishwanatha, J. K. (2012). Scale up, optimization and stability analysis of Curcumin C3 complex-loaded nanoparticles for cancer therapy. Journal of Nanobiotechnology, 10, 1-18.
Semete, B., Booysen, L., Lemmer, Y., Kalombo, L., Katata, L., Verschoor, J., & Swai, H. S. (2010). In vivo evaluation of the biodistribution and safety of PLGA nanoparticles as drug delivery systems. Nanomedicine, 6(5), 662-671. https://doi.org/10.1016/j.nano.2010.02.002
Shaikh, J., Ankola, D. D., Beniwal, V., Singh, D., & Kumar, M. N. (2009). Nanoparticle encapsulation improves oral bioavailability of curcumin by at least 9-fold when compared to curcumin administered with piperine as absorption enhancer. Eur J Pharm Sci, 37(3-4), 223-230. https://doi.org/10.1016/j.ejps.2009.02.019
Wang, F., Shu, G., Peng, X., Fang, J., Chen, K., Cui, H., Chen, Z., Zuo, Z., Deng, J., Geng, Y., & Lai, W. (2013). Protective effects of sodium selenite against aflatoxin B1-induced oxidative stress and apoptosis in broiler spleen. Int J Environ Res Public Health, 10(7), 2834-2844. https://doi.org/10.3390/ijerph10072834
Wang, M., Ruan, Y., Chen, Q., Li, S., Wang, Q., & Cai, J. (2011). Curcumin induced HepG2 cell apoptosis-associated mitochondrial membrane potential and intracellular free Ca2+ concentration. European journal of pharmacology, 650(1), 41-47.
Sexto Congreso Nacional de Tecnología 18, 19 y 20 de octubre de 2023,
celebrado en formato virtual

D. R. © UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO.
Excepto donde se indique lo contrario esta obra está bajo una licencia Creative Commons Atribución No comercial, No derivada, 4.0 Internacional (CC BY NC ND 4.0 INTERNACIONAL).
https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es

ENTIDAD EDITORA
Facultad de Estudios Superiores Cuautitlán.
Av. Universidad 3000, Universidad Nacional Autónoma de México, C.U., Delegación Coyoacán, C.P. 04510, Ciudad de México.
FORMA SUGERIDA DE CITAR:
Díaz-Torres, R., Méndez-Albores, J. A., y Ramírez-Noguera, P. (2023). Nanopartículas de PLGA y PLGA-PEG con curcumina y su efecto sobre aflatoxina B1 in vitro. MEMORIAS DEL CONGRESO NACIONAL DE TECNOLOGÍA (CONATEC), Año 6, No. 6, septiembre 2023 - agosto 2024. Facultad de Estudios Superiores Cuautitlán. UNAM. https://tecnicosacademicos.cuautitlan.unam.mx/CongresoTA/memorias2023/Mem2023_Paper13-E.html