Inicio / Archivo / Año 6, No 6, septiembre 2023 - agosto 2024 / Paper 20

EFECTO DE LIPOSOMAS CARGADOS CON GSH SOBRE LA ACTIVIDAD DE ENZIMAS ANTIOXIDANTES
Rafael Alejandro Rodríguez-Salazar*, Laura Denise López-Barrera, Patricia Ramírez-Noguera y Roberto Díaz-Torres
UNAM FES Cuautitlán
*raphalexrs@gmail.com
Resumen
Existen diferentes tratamientos para la Osteoartritis, sin embargo, están enfocados en contrarrestar los signos y síntomas de la enfermedad, por ello el objetivo de este trabajo fue generar liposomas con glutatión para evaluar el efecto sobre la actividad de enzimas antioxidantes en condrocitos de rata tratados previamente con peróxido de hidrógeno, enfocándose en el efecto del estrés oxidante. Se realizó un cultivo primario a partir de condrocitos de rata extraídos del xifoides, posteriormente se prepararon los liposomas y se les realizó caracterización, finalmente se llevó a cabo la medición de la actividad de las enzimas glutatión peroxidasa (GPx) y reductasa (GRx).; Los resultados se analizaron mediante una ANOVA de una vía, seguido de un análisis de comparación múltiple de medias de Fisher con un p<0.05. En cuanto a la caracterización los liposomas de GSH tuvieron un tamaño de 493.4 nm, un potencial Z de -7.79 mV y un % de GSH de 99.2%. Los liposomas sin GSH tuvieron un tamaño de 182.4 nm y un potencial Z de -15.0 mV, lo que sugiere que pueden entrar a las células por sus propiedades fisicoquímicas. Los resultados de la exposición de liposomas con glutatión en la actividad de GRx mostró niveles similares al de las células no tratadas en la exposición combinada con Peróxido, y el mismo efecto se mostró en GPx. Sin embargo, tanto en GRx como GPx se observa una actividad elevada significativa en un tratamiento de liposomas sin GSH seguido por una exposición a Peróxido, lo cual evidencia que la exposición de los liposomas tiene una mejor respuesta si se realiza antes. Estos resultados son preliminares, por lo cual debe realizarse la medición de otros biomarcadores para corroborar el efecto generado.
Palabras clave:Condrocitos, Glutatión, reductasa, peroxidasa, osteoartritis, H2O2.
Introducción
La osteoartritis (OA) es la enfermedad reumática a nivel mundial más frecuente en la población adulta y mayor de 65 años, provocando discapacidad y morbilidad. Caracterizada principalmente por daño a nivel del cartílago, incremento en las especies reactivas de oxígeno, nitrógeno, así como inflamación. El desequilibrio en las especies reactivas de oxígeno (EROs) y la capacidad antioxidante de las células, se le denomina estrés oxidante. La mitocondria es la fuente principal de EROs y estas mismas pueden inducir una desregulación mitocondrial al aumentar la permeabilidad de la membrana, lo que aumenta aún más la producción de EROs. Bajo estas condiciones se activa el mecanismo de defensa para eliminar el exceso de estas moléculas en la célula. El sistema de defensa antioxidante celular incluye enzimas, como glutatión peroxidasa (GPx), glutatión reductasa (GRx), entre otras.
En estas enfermedades, el glutatión GSH se ve reducido con el envejecimiento en múltiples células y de igual forma los pares redox que proporcionan los equivalentes reductores necesarios, como lo es NAD+/NADH y NADP+/NADPH. Por lo tanto, la resiliencia deteriorada del glutatión puede contribuir al estrés oxidante biomecánico e inflamatorio en los condrocitos (Zhu, 2019).
Los liposomas de GSH debido a su capacidad antioxidante podrían ser utilizados en este tipo de enfermedades que están asociadas al desequilibrio redox. Tienen varias ventajas como aumentar la absorción celular de los fármacos, estabilizar los productos fisicoquímicos y la biodisponibilidad de los respectivos fármacos solubles en agua o poco solubles en agua. La repulsión electrostática, repulsión estérica y una fuerte hidratación podrían afectar la estabilidad liposomal (Rezaei, 2019; Lin, 2019). Por ello, los nanosistemas representan un tratamiento innovador para contrarrestar los signos y síntomas de estas enfermedades.
Objetivo
Evaluar el efecto antioxidante de liposomas cargados con glutatión (GSH) a través de la medición de enzimas antioxidantes glutatión reductasa y peroxidasa, en condrocitos de rata.
Materiales y métodos
Preparación de Liposomas
Se empleó el método de Bangham para la preparación de liposomas tanto vacíos y cargados con GSH. Consiste en dos etapas, primero se prepara una película lipídica empleando Fosfatidilcolina, el cual se preparó al 0.003% de etanol, enseguida se agregó una mezcla 10:10 de cloroformo/metanol, se vació la mezcla en el matraz de evaporación y se colocó en rotavapor a 40°C, 50 rpm durante 1 h. Posteriormente, se hidrata la película, para ello se preparó una solución de sacarosa al 10%, y en el caso de los liposomas cargados se disuelve en esta solución 0.5% de glutatión, finalmente se agrega la solución al matraz de evaporación con la película lipídica a 40 °C, 50 rpm, por 1 h. Concluida la hora se dejó reposar en baño maría a 40 °C por 2 h. Y pasado el tiempo se sonicaron los liposomas en ultrasonido Elma por 3 minutos a 40 °C.
Caracterización del tamaño
Tamaño de Partícula y Potencial Z: Se colocaron en celdas la muestra de liposomas y por medio de zetasizer se calculó el índice de polidispersión, el tamaño de partícula y su potencial Z, el instrumento ajustó a temperatura ambiente por 1 min y realizó 100 mediciones por 5 corridas para cada muestra.
Porcentaje de Encapsulación
De igual manera, se evaluó el porcentaje de encapsulamiento de los liposomas cargados con GSH, para ello se prepararon 6 tubos eppendorf con 20μL de liposomas y 1980μL de solución sacarosa al 10% en cada tubo respectivamente, luego se centrifugaron los sistemas a 4000 rpm, 2 h a 4 °C. Concluida la centrifugación se tomaron 400μL del sobrenadante de los sistemas y se colocaron en 6 tubos eppendorf nuevos, se les adicionó 600μL de PBS; Se preparó una curva de calibración para determinar el volumen de la reacción entre el glutatión y el reactivo de Ellman.
Obtención de cartílago articular de rata wistar
El sacrificio se llevó a cabo, por dislocación cervical en una rata wistar evitando alteraciones bioquímicas, se realizó un corte en el esternón y se extrajo la apófisis xifoide, posteriormente colocando el tejido en un tubo eppendorf con solución PBS/antibiótico 10% se cortó en pequeñas porciones empleando un bisturí en condiciones de esterilidad y una vez triturado se realizaron 6 centrifugaciones con lavados de PBS/antibiótico 1%.
Cultivo Celular Primario
Concluidos los lavados, se retiró el PBS y se le añadió colagenasa al 0.01% en medio de cultivo y se colocó en incubadora de rotación a 30 rpm, 7 h a 37°C. Después se centrifugó nuevamente a 12,000 rpm, 3 min a 37°C; Se retiró el medio con colagenasa y se resuspendió en 1mL de medio de cultivo.
Se tomó el pellet resuspendido para 2 botellas T25 con medio de cultivo previamente añadido y se dejó proliferar hasta alcanzar 60% de confluencia realizando lavados con PBS estéril.
Una vez alcanzada la confluencia, las células se tripsinizaron y se llevaron a un siguiente pase. Esto se realizó hasta llegar a un pase 2, se realizó un conteo con azul de tripano en cámara de neubauer, y en cajas de cultivo de 6 pozos se colocaron 10,000 células por pozo y se dejaron proliferar hasta alcanzar un 90% de confluencia.
Actividad de enzima GRx
Se prepararon en el momento los reactivos para la prueba, siendo el buffer de fosfato de potasio 0.1M, GSSG, NADPH y el H2O2 300 µM, se preparó una solución al 25% de las muestras en agua grado millipore, posteriormente en placas ELISA se colocaron en orden por pozo 40 µL de la dilución de la muestra, 50 µL de buffer de fosfato de potasio, 5 µL de GSSG y 5 µL de NADPH, se dejó equilibrar 3 minutos y se leyó en espectrofotómetro la disminución de lectura a longitud de onda de 340 nm.
Actividad de enzima GPx
Se prepararon los reactivos el día de la prueba siendo el buffer de fosfato de sodio 0.1M, GSH, Azida de sodio, NADPH, GRx y H2O2 300 µM. En placas ELISA de 96 pozos se colocaron por pozole el siguiente orden 31.5 µL de buffer de fosfato de sodio, 5 µL de GSH, 0.5 µL de azida de sodio, 0.5 µL de GRx, 7.5µL de la muestra, 5 µL, 5 µL de NADPH y 2.5 µL de H2O2 enseguida se leyó en espectrofotómetro a una longitud de onda de 340 nm.
Resultados
Viabilidad de Liposomas
Se evaluó el tamaño de partícula y potencial Z de la formulación de los liposomas, en la Figura 1 para los liposomas vacíos se obtuvo un índice de polidispersión de 0.209, tamaño de 233.3 d.nm y un potencial Z de -15.0.
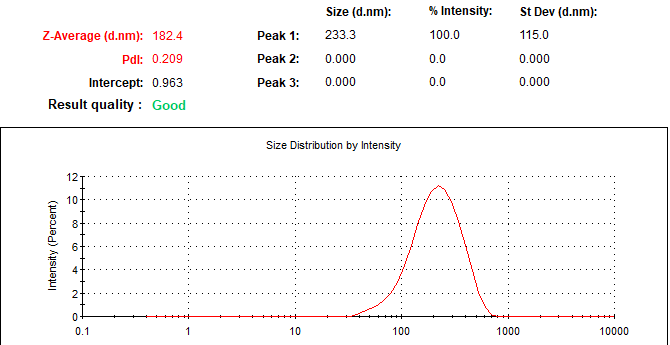
Figura 1. Liposomas sin GSH.
En el caso de los liposomas cargados con GSH, un índice de polidispersión de 0.253, tamaño de 570.5 d.nm, un potencial Z de -8.91 y un porcentaje de encapsulación de 97.9%.
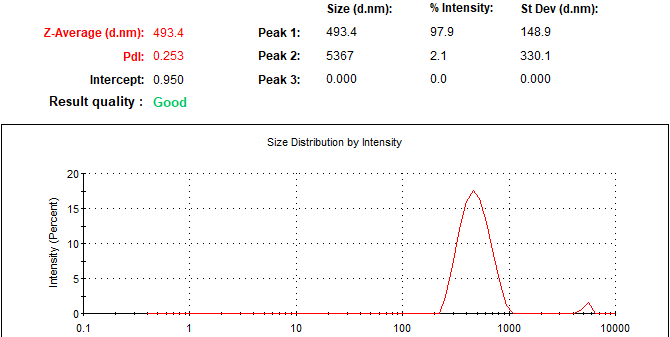
Figura 2. Liposomas GSH.
Actividad de Glutatión Reductasa
En la Figura 3, se observa la evaluación de la actividad de la enzima GRx. En los tratamientos únicamente expuestos con liposomas no existió un cambio significativo con respecto a la media de las células no tratadas y para los tratamientos con expuestos con H2O2 primero, seguidos de liposomas, tampoco mostraron un cambio significativo en la actividad, a excepción del tratamiento con liposomas vacíos con concentración alta donde se observa un aumento significativo de la actividad.
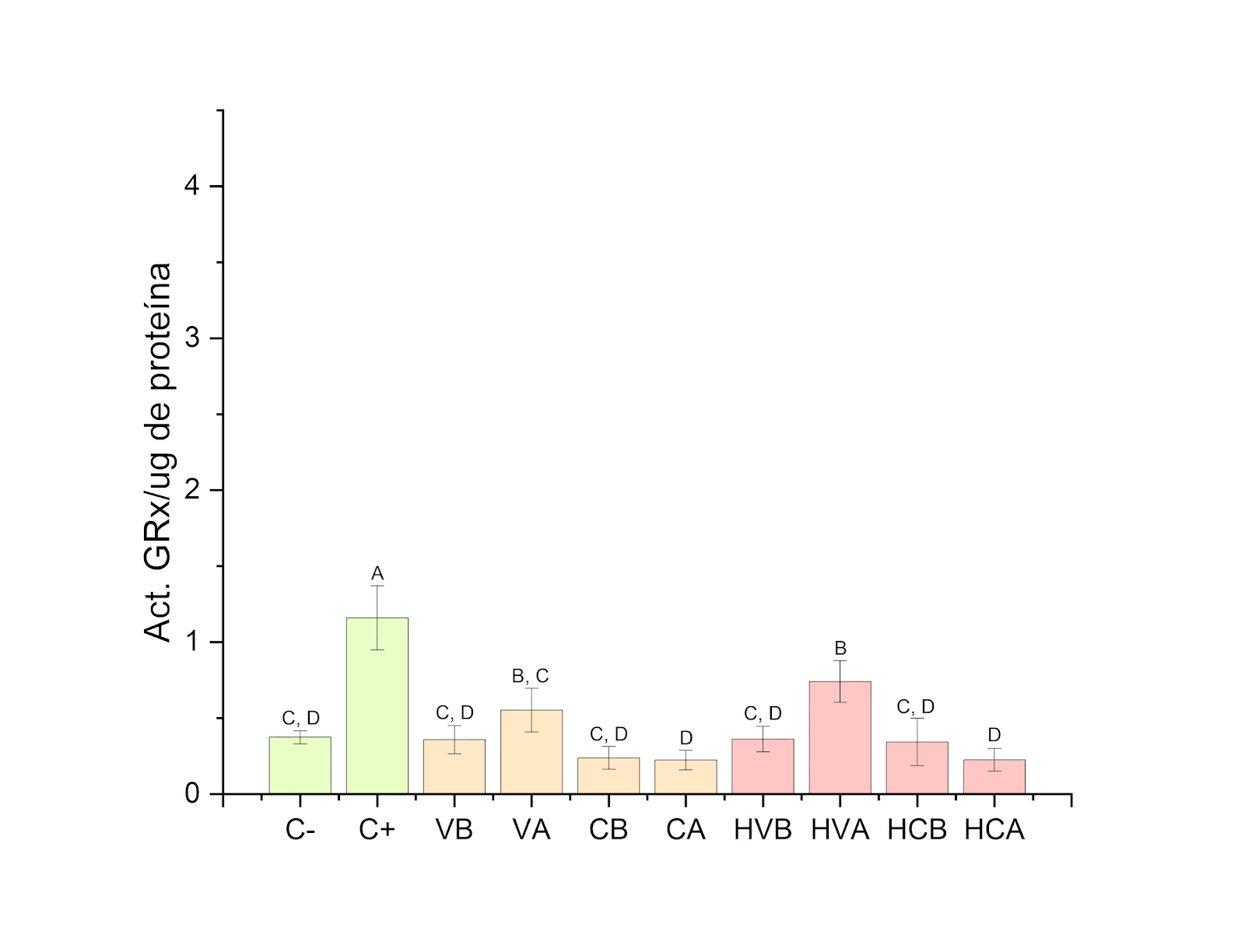
Figura 3. Actividad de la enzima glutatión reductasa en los diferentes tratamientos cuando se expone primero 30 min a H2O2 y posteriormente 2 h a liposomas.
Cuando se realizó una exposición primero a liposomas y posteriormente a H2O2, la actividad de la GRx aumentó de manera significativa para los tratamientos con liposomas vacíos en ambas concentraciones, mientras que la concentración en liposomas con GSH disminuyó significativamente (Figura 4).
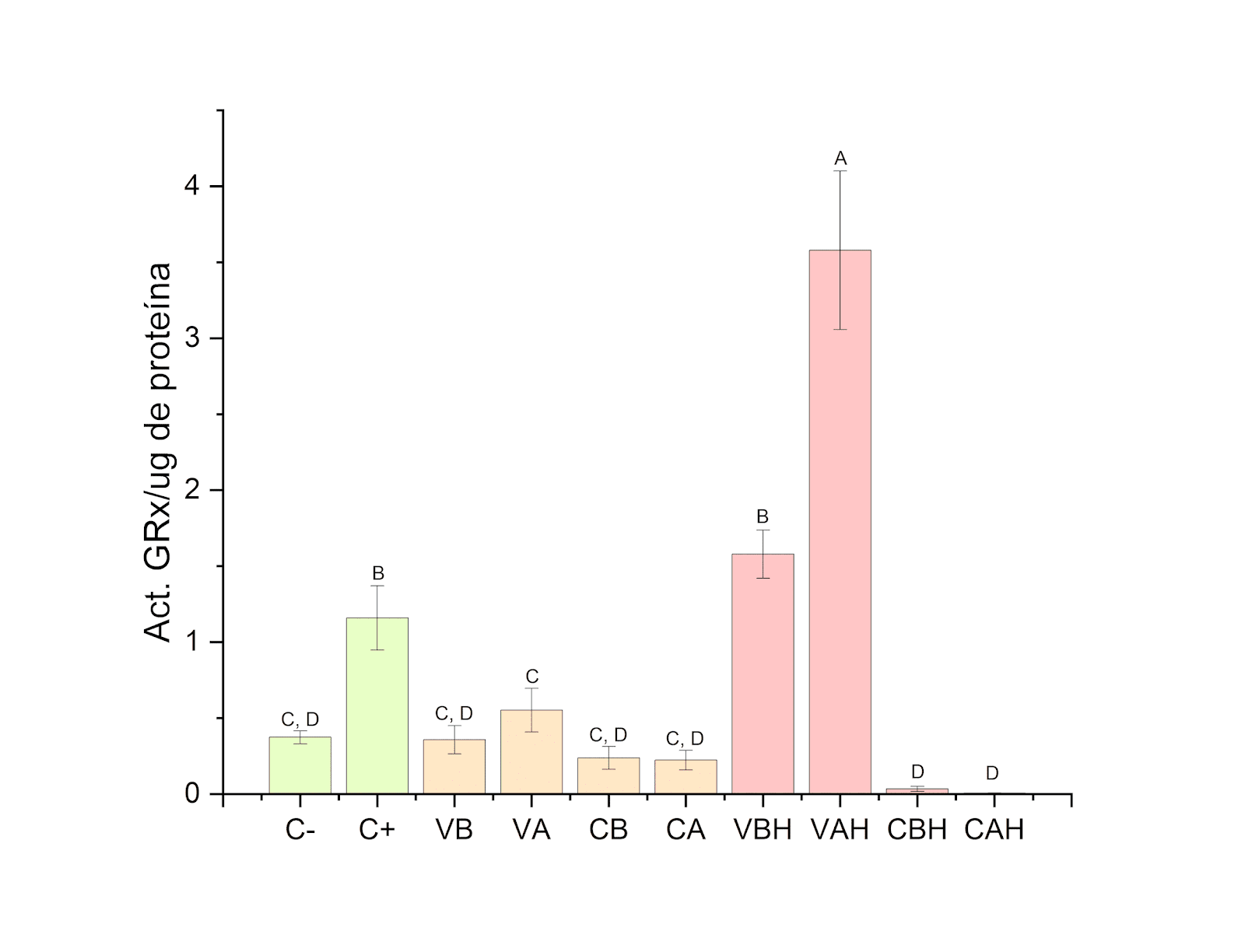
Figura 4. Actividad de la enzima glutatión reductasa en los diferentes tratamientos cuando se expone primero 2 h a liposomas y posteriormente 30 min a H2O2.
Mediante una adaptación del método de Paglia y Valentine se evaluó la actividad de GPx. Para los tratamientos puramente con liposomas no existe una alteración en la actividad de la enzima significativa con respecto a la media de las células no tratadas, en los tratamientos expuestos con H2O2 de misma forma no mostraron un cambio significativo en la actividad con respecto a la media de las células no tratadas (Figura 5).
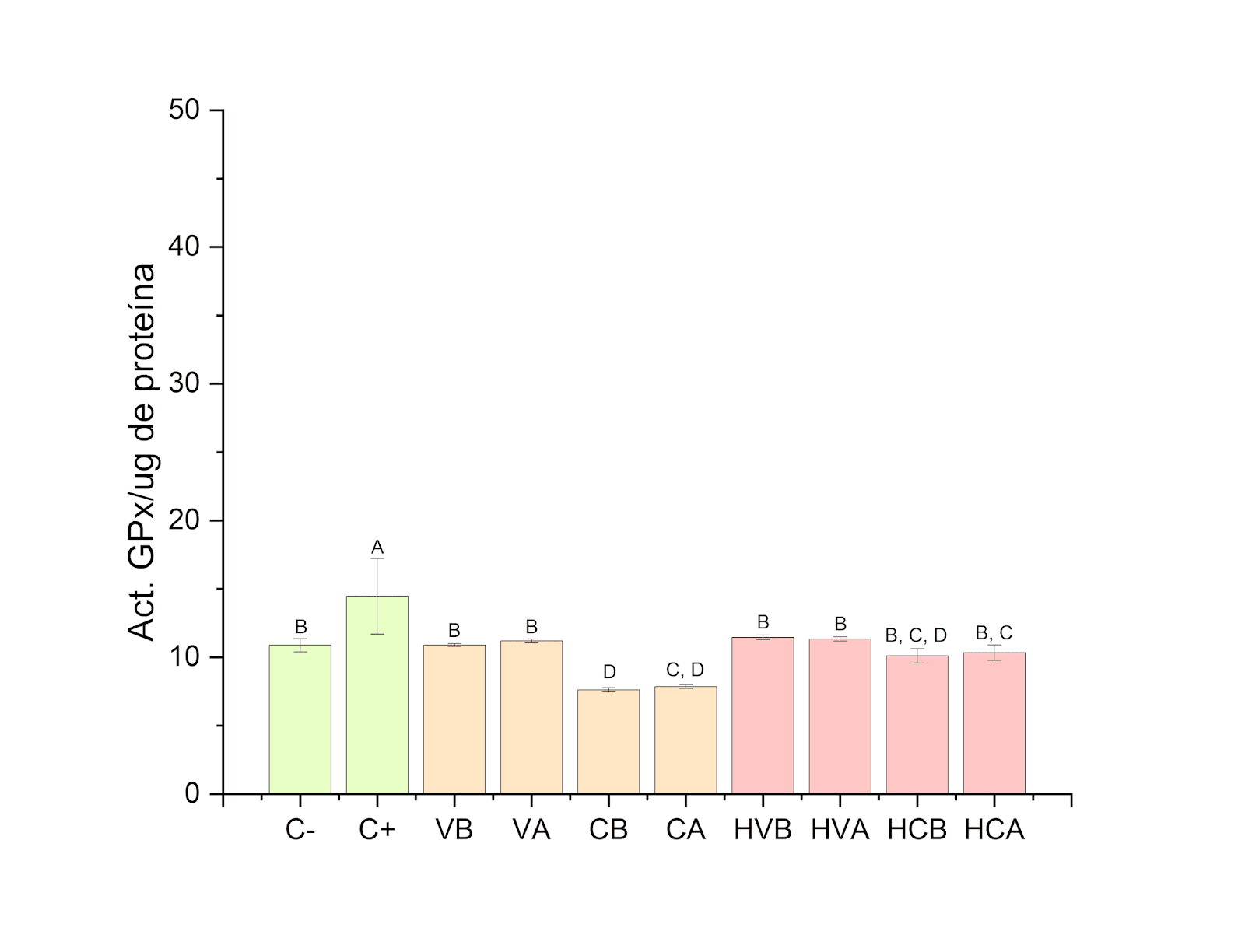
Figura 5. Actividad de la enzima glutatión peroxidasa en los diferentes tratamientos cuando se expone primero 30 min a H2O2 y posteriormente 2 h a liposomas.
En la Figura 6 se observan los tratamientos a liposomas primero y seguido por exposición a H2O2, los tratamientos con liposomas vacíos muestran una elevación significativa con respecto de nuestras células no tratadas y tratadas únicamente con H2O2, mientras que los tratamientos con liposomas con GSH se mantuvieron sin cambios significativos.
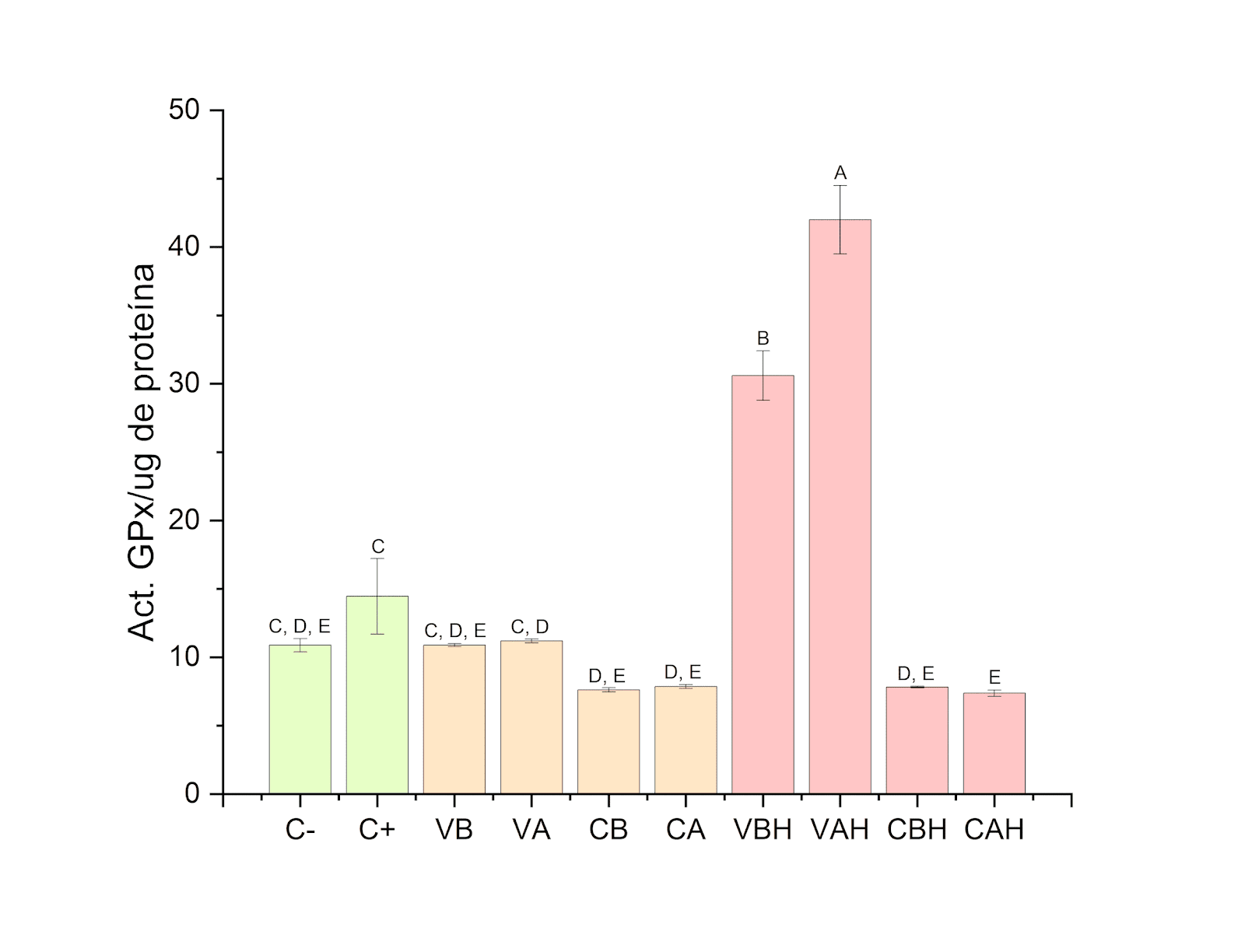
Figura 6. Actividad de la enzima glutatión peroxidasa en los diferentes tratamientos cuando se expone primero 2 h a liposomas y posteriormente 30 min a H2O2.
Discusión
La formulación de liposomas tanto cargados con GSH como vacíos se basa en el método de Bangham o hidratación de película delgada. El índice de polidispersión nos indica cómo se encuentran distribuidos los tamaños de las partículas presentes en la suspensión, se considera un tamaño homogéneo para un valor menor o igual a 0.2, indicando que para nuestros liposomas se considera que las moléculas se encuentran en un tamaño homogéneo (Suárez, 2019). El tamaño de los liposomas nos dice que son capaces de entrar a la célula por endocitosis. Y por último dado que la mayoría de las membranas celulares están cargadas negativamente, el potencial zeta nos indica que tendrán tendencia a penetrar las membranas (Clogston, 2011).
Glutatión reductasa (GRx) es una Flavoenzima dependiente del nicotinamín adenín dinucleótido fosfato reducido (NADPH) que cataliza la reducción del glutatión oxidado (GSSG) durante el ciclo redox del glutatión. El GSSG se genera por la reacción no enzimática de radicales con glutatión reducido (GSH) y es producto de las reacciones catalizadas por glutatión peroxidasas, que utilizan al GSH como donador de electrones para la reducción de peróxidos (Dringen, 2002). Por tanto, la alteración de la actividad de la GRx nos permite correlacionar los cambios en los niveles de GSH y los niveles de EROs. Los resultados referentes a esta enzima nos dicen que los liposomas con GSH están proporcionando el GSH necesario en la respuesta al estrés oxidante generado por el H2O2 presente en las células, por ello no se activa el sistema antioxidante de la enzima.
La GPx cataliza la reducción de un peróxido orgánico (ROOH), oxidando el glutatión reducido para formar disulfuro de glutatión (GSSG). El GSH luego es reducido por la GRx y el NADPH formado NADP+ (resultando en una disminución de la absorbancia a 340 nm) y reciclando el GSH. Debido a que la GPx es limitante, la disminución de la absorbancia a 340 nm es directamente proporcional a la actividad GPx en la muestra (Paglia, 1967). Un cambio en la actividad de la GPx nos permite estimar el nivel de estrés oxidante en las células, ya que esta inhibe la peroxidación de lípidos. Los resultados nos muestran que el sistema antioxidante de la GPx no está actuando ya que los liposomas están proporcionando suficiente GSH para descomponer el H2O2 presente en las células, este comportamiento es semejante al observado por la GRx debido a que van de la mano ambos sistemas.
Conclusión
De acuerdo con los resultados obtenidos, los liposomas tanto en la actividad de glutatión reductasa como peroxidasa no muestra diferencias significativas en comparación del control negativo cuando se exponen las células primero y después al peróxido de hidrógeno.
Estos resultados sugieren que, si pudiese existir un efecto protector por parte de los liposomas con GSH, sin embargo, se debe realizar la medición de otros biomarcadores para corroborar el efecto.
Agradecimientos
Al proyecto PAPIIT DGAPA ‘’Estudio de la respuesta antioxidante inducida por nanopartículas de quitosán con glutatión en la osteoartrosis, estudio in vitro e in vivo” clave IN214321 por el apoyo otorgado.
Referencias
Clogston, D. J., & Patri, K. A. (2011). Zeta potential measurement. Methods Mol Biol, 697,63-70. doi: 10.1007/978-1-60327-198-1_6.
Dringen, R., & Gutterer, J. M. (2002). Glutathione reductase from bovine brain. Methods in Enzymology, 348, 281-288
Lin, W., Kampf, N., Goldberg, R., Driver, M. J., & Klein, J. (2019). Poly-Phosphocholinated Liposomes Form Stable Superlubrication Vectors. Langmuir, 35(18), 6048-6054. doi: 10.1021/acs.langmuir.9b00610.
Paglia, D., & Valentine, W. (1967). Studies on the quantitative and qualitative characterization of erythrocyte glutathione peroxidase. Journal of Laboratory and Clinical Medicine, 70, 158-169.
Rezaei, N., Mehrnejad, F., Vaezi, Z., Sedghi, M., Asghari, M. S., & Naderi, M. H. (2019). Encapsulation of an endostatin peptide in liposomes: Stability, release, and cytotoxicity study. Colloids and Surfaces B: Biointerfaces, 185, 110552. https://doi.org/10.1016/j.colsurfb.2019.110552
Suárez, H. M, & Brito, D. C. (2019). Eficiencia de encapsulación y capacidad de carga de antocianinas de Vaccinium floribundim Kunt en nanoparticulas de zeina. InfoANALÍTICA, 8(1), 83-97.
Zhu, S., Makosa, D., Miller, B., & Griffin, T. M. (2019). Glutathione as a mediator of cartilage oxidative stress resistance and resilience during aging and osteoarthritis. Connective Tissue Research, 61(1), 34-47. https://doi.org/10.1080/03008207.2019.1665035.
Sexto Congreso Nacional de Tecnología 18, 19 y 20 de octubre de 2023,
celebrado en formato virtual

D. R. © UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO.
Excepto donde se indique lo contrario esta obra está bajo una licencia Creative Commons Atribución No comercial, No derivada, 4.0 Internacional (CC BY NC ND 4.0 INTERNACIONAL).
https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es

ENTIDAD EDITORA
Facultad de Estudios Superiores Cuautitlán.
Av. Universidad 3000, Universidad Nacional Autónoma de México, C.U., Delegación Coyoacán, C.P. 04510, Ciudad de México.
FORMA SUGERIDA DE CITAR:
Rodríguez-Salazar, R. A., López-Barrera, L. D., Ramírez-Noguera, P., y Díaz-Torres, R. (2023). Efecto de liposomas cargados con GSH sobre la actividad de enzimas antioxidantes. MEMORIAS DEL CONGRESO NACIONAL DE TECNOLOGÍA (CONATEC), Año 6, No. 6, septiembre 2023 - agosto 2024. Facultad de Estudios Superiores Cuautitlán. UNAM. https://tecnicosacademicos.cuautitlan.unam.mx/CongresoTA/memorias2023/Mem2023_Paper20-EC.html