Inicio / Archivo / Año 6, No 6, septiembre 2023 - agosto 2024 / Paper 21

ESTUDIO DE LA CAPACIDAD ANTIOXIDANTE DE DOS NANOSISTEMAS EN CULTIVOS ORGANOTÍPICOS DE CARTÍLAGO DE RATA
Ximena Hernández-Moncada*, Laura Denise López-Barrera, Patricia Ramírez-Noguera y Roberto Díaz-Torres
UNAM FES Cuautitlán,
*hernandezmoncadaximena@gmail.com
Resumen
La osteoartritis es una enfermedad inflamatoria-degenerativa que afecta el estado redox de los condrocitos. Sin embargo, los avances científicos en la nanociencia han desarrollado nanosistemas que permiten la introducción de moléculas antioxidantes para su aprovechamiento al interior de las células. Por otra parte, el glutatión (GSH) es la molécula que posee mayor relevancia a nivel celular debido a sus funciones de defensa antioxidante y mantenimiento del balance redox intracelular. Este estudio tiene como objetivo comparar el efecto antioxidante de dos sistemas de nanoestructuras con capacidad antioxidante en cultivos organotípico de cartílago de rata, a través de la medición de biomarcadores de estrés oxidante. Durante el procedimiento se realizó el cultivo organotípico proveniente del cartílago de costillas de rata Wistar en donde se evaluaron los siguientes tratamientos: control negativo, control positivo usando el estresor peróxido de hidrógeno; liposomas y nanopartículas en concentración alta y baja con GSH y vacías. Se realizaron pruebas de cuantificación de GSH, lipoperoxidación (TBARS) y porcentaje de especies reactivas de oxígeno (%EROs). Para evaluar si había diferencias significativas entre los tratamientos se realizó ANOVA de una vía, seguido de un análisis post hoc de comparación múltiple de media de Fisher con un p<0.05. Los resultados de la cuantificación de GSH señalan la diferencia entre ambos nanosistemas, siendo las nanopartículas similares al control positivo; la lipoperoxidación es menor con liposomas en comparación con nanopartículas; el %EROs no tienen diferencias significativas entre los grupos de liposomas y nanopartículas. Por lo tanto, mostrando ambas el mismo efecto. No obstante, debido a sus diferencias estructurales, se requiere realizar otras pruebas para explicar el comportamiento de las nanopartículas y los liposomas.
Palabras clave: Osteoartritis, Glutatión, Nanopartículas, Liposomas
Introducción
La osteoartritis es la enfermedad más frecuente en los adultos de la tercera edad y ha sido relacionada con el estrés oxidante; siendo esta que ocurre en el cartílago articular. Por esta razón, surge la necesidad de estudiar sus posibles alternativas terapéuticas, los fármacos convencionales favorecen la disminución de los signos y síntomas. Sin embargo, no tienen un efecto en etapas tardías, por tal motivo se ha usado a la nanociencia para la fabricación de sistemas nanoestructurados, con el objetivo de mejorar las respuestas en estadios tempranos y tardíos.
El cultivo organotípico tiene la característica fundamental que permite mantener, cierta parte de la estructura anatómica del tejido in vivo debido a que se conservan las interacciones histológicas que permite mantener los tipos celulares diferenciados, lo que juega un papel importante para un modelo de estudio donde se pretende obtener una réplica del tejido de origen (García, 2002).
La nanotecnología es el estudio y la manipulación de materia en tamaños generalmente entre uno y 1000 nanómetros. Las nanopartículas son definidas como partículas que son más pequeñas que 1000 nanómetros (milmillonésima parte de un metro). En el campo de la medicina, se pueden usar nanopartículas para transportar anticuerpos, medicamentos, elementos para las pruebas con imágenes y otras sustancias hasta ciertas partes del cuerpo. Las nanopartículas están en estudio para la detección, el diagnóstico y el tratamiento de cáncer. Las nanopartículas lipídicas fueron desarrolladas como un sistema de transporte alternativo a las emulsiones, liposomas y nanopartículas poliméricas; también, presentan una mejor biodisponibilidad, protegen las moléculas de fármacos susceptibles de degradarse bajo la influencia de agentes externos como la luz y el agua, y podrían ser de liberación prolongada para sustancias activas poco solubles en agua incorporadas en la matriz lipídica sólida (Villafuerte et al., 2008).
En este estudio se pretende utilizar un cultivo celular organotípico de cartílago de rata para estudiar y analizar su actividad a nivel celular del condrocito en un microambiente parecido al fisiológico, a través de la exposición de sistemas nanoestructurados cargadas con antioxidantes para disminuir el estrés oxidante inducido.
Objetivo
Comparar el efecto antioxidante de dos sistemas nanoestructurados con capacidad antioxidante en cultivos organotípicos de cartílago de rata, a través de biomarcadores de estrés oxidante.
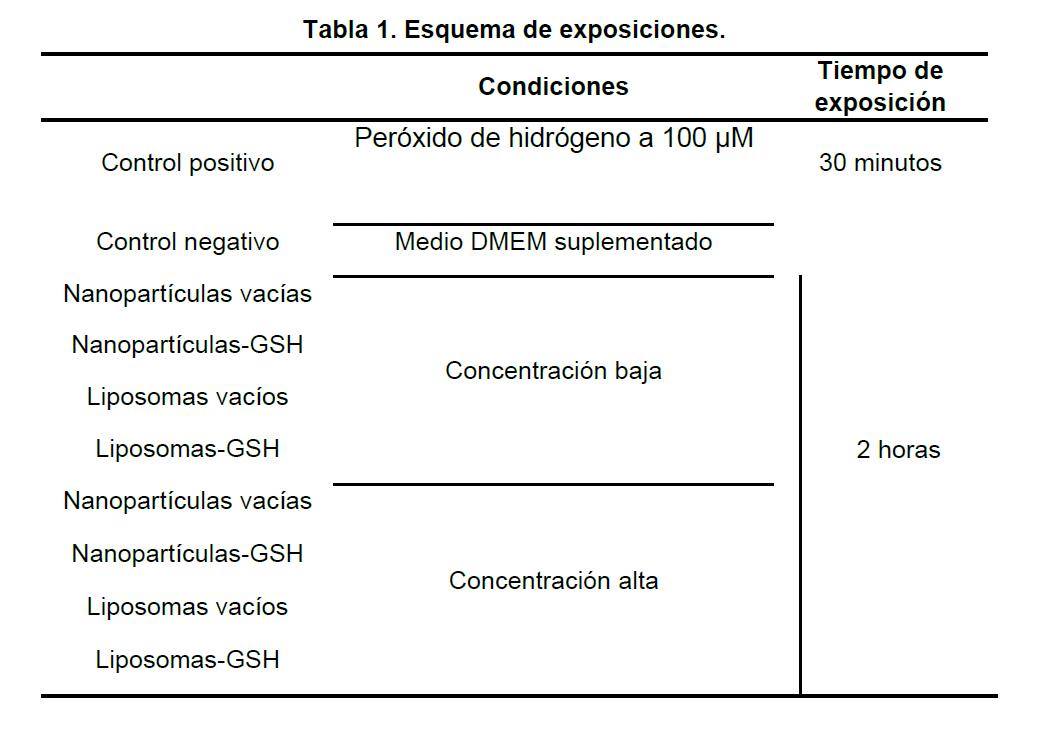
Materiales y métodos
Nanopartículas de Quitosán y GSH
- Solución de ácido acético al 1% a pH de 4.1
- Pluronic F-68
- Solución de tripolifosfato al 0.1% en solución ácida al 1%
- Quitosán de bajo peso molecular
- L-Glutatión Reducido
- Glicerol 99%
Liposomas de Colesterol y GSH
- L-alfa-Fosfatidilcolina de Soya
- Alcohol etílico absoluto
- Cloroformo
- Metanol
- Sacarosa al 10%
- L-Glutatión Reducido
Cultivo organotípico
- Medio de cultivo DMEM suplementado y antibiótico
- Buffer Krebs- Henseleit
- Buffer de disección
- Placa de 96 pozos
- Incubadora de temperatura controlada
- Vibratomo
Preparación de Nanopartículas de quitosán y GSH
La síntesis de nanopartículas de quitosán se realiza a partir del método de gelación iónica. Se prepara la solución de ácido acético al 1% a pH 4.1 - 4.2 que posteriormente se usa para disolver Pluronic F-68 con quitosán (solución 1) y TPP (solución 2). Ambas soluciones se filtran y después se agrega GSH a la solución 1. Por último, se incorporan ambas soluciones por goteo constante y se filtran usando membranas de 0.65 y 0.45 para esterilizarlas.
Preparación de Liposomas de colesterol y GSH
El protocolo para liposomas indica que se debe disolver fosfatidilcolina en etanol y llevar al termoagitador, posteriormente se agrega el colesterol junto a una mezcla 1:1 de cloroformo y metanol. Se mezcla en el rotavapor, mientras se prepara la siguiente solución sacarosa al 10% y adicionar GSH. Ambas soluciones se mezclan en el rotavapor y se sonican. Por último, se filtran usando membranas de 0.65 y 0.45 para esterilizarlas.
Preparación del cultivo organotípico
De acuerdo con lo realizado en el laboratorio, se obtiene el cartílago hialino de las costillas de rata Wistar y se realizan lavados con buffer de Krebs - Henseleit. En el microtomo se realizan los cortes y se mantienen en el buffer de disección hasta que se reparten en la placa que contendrá el medio DMEM suplementado y con antibiótico.
Terminado el tiempo de incubación se almacenan los cortes en buffer de lisis por un mínimo de 72 h en el congelador. Después se disgrega el tejido usando el sonicador y se realizan las pruebas experimentales: cuantificación de EROs, cuantificación de GSH y cuantificación de TBARS.
Resultados
Esquemas de exposiciones
%EROs
Los resultados de los controles demuestran que para el control negativo existe un porcentaje de especies reactivas inferior (menor al 70%) comparado con el control positivo al cual se adicionó el estresor peróxido de hidrógeno a una concentración de 100 µM con el fin de producir estrés celular.
Como se ilustra en la Figura 1, se observa la diferencia significativa existente entre el control positivo y los demás tratamientos que corresponden a los liposomas, manteniéndose en resultados similares junto al control negativo. Una respuesta parecida ocurre con las nanopartículas.
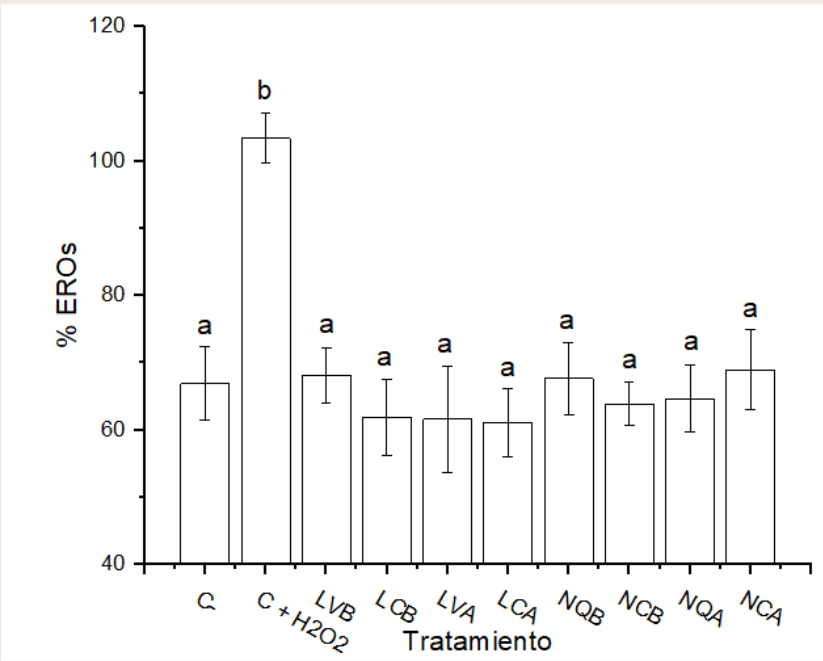
Figura 1. Cuantificación de %EROs en los nanosistemas expuestos.
GSH
En primera instancia, el control negativo muestra los niveles basales de GSH en las células sin tratamiento; por el contrario, el control positivo muestra un incremento en los niveles de GSH de las células expuestas al agente estresor.
Por otro lado, en la Figura 2 se muestran los resultados para liposomas, siendo que no hay diferencias significativas entre los liposomas cargados y los vacíos, sin embargo, en los liposomas cargados se puede observar un menor nivel. En los resultados de nanopartículas se puede observar que NQB, NCB y NCA presentan resultados similares al control positivo, incrementando los niveles de glutatión, mientras que NQA mostraron resultados similares a los observados en los liposomas.
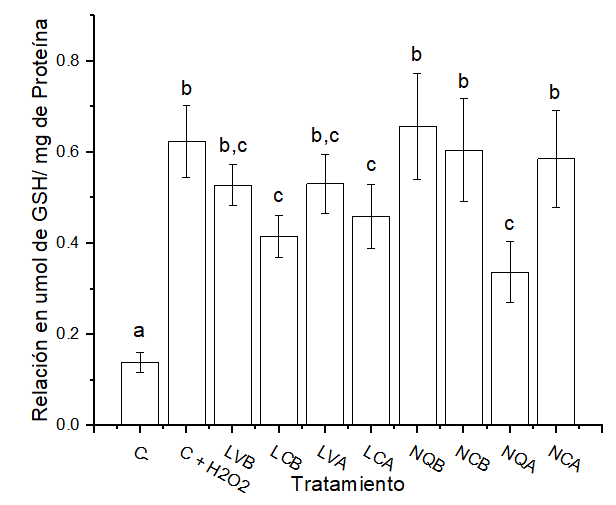
Figura 2. Cuantificación de GSH en los nanosistemas expuestos.
TBARS
En la Figura 3 se observan los resultados de MDA para los nanosistemas. El control negativo presenta niveles basales de MDA, mientras que el control positivo es el contrario, los niveles del producto de lipoperoxidación se encuentran notablemente incrementados.
Los liposomas presentan resultados similares al control negativo tanto para vacíos y cargados. La misma respuesta ocurre con las nanopartículas de quitosano cargadas y vacías, excepto para la exposición de nanopartículas con GSH de baja concentración.
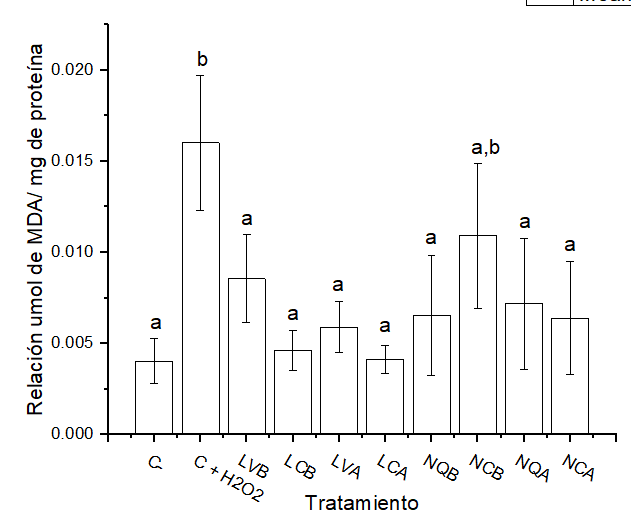
Figura 3. Cuantificación de MDA por método de TBARS en los nanosistemas expuestos.
Discusión
Después de las dos horas de incubación del cultivo de cartílago de rata Wistar se realiza la primera prueba de porcentaje EROs que consiste en la cuantificación de las especies reactivas de oxígeno producidas en el tejido y usando el reactivo diclorofluoresceína para su identificación (Pérez et al., 2000).
La cuantificación de %EROs en los nanosistemas indican que la respuesta de ambos no representa diferencias significativas, se puede sugerir que su vectorización no indujo estrés a la célula, lo cual puede deberse a su tamaño, así como al glutatión presente en los liposomas como en las nanopartículas, ya que es uno de los antioxidantes más importantes en las células (Rizeq et al., 2019).
En la prueba de glutatión en el tejido se utiliza el buffer de reacción que contiene DTNB que reacciona con el glutatión oxidado para obtener el glutatión total presente en la muestra. El GSH en el tejido es el antioxidante introducido en el cartílago a partir de nanopartículas y liposomas (Forman & Rinna, 2009).
Los anteriores resultados mostrados sugieren que el origen del GSH encontrado es de origen endógeno, es decir, producido en el interior de la célula, ya que esto explicaría por qué los nanosistemas vacíos se encuentran concentraciones de GSH mayores en comparación de las que están cargadas con el antioxidante (Denzoin et al., 2013).
En el caso de los cargados debido a la presencia de glutatión en los nanosistemas se podrían estar activando a nivel celular mecanismos de regulación para la síntesis del glutatión, ya que a nivel celular grandes cantidades de este antioxidante inhiben la actividad de la enzima gamma-glutamilcisteína-sintetasa esto puede ser parte de la respuesta del tejido a la entrada de los nanosistemas como mecanismo de regulación para la síntesis de glutatión (Denzoin et al., 2013).
También hay que considerar que el cartílago está compuesto por matriz extracelular y condrocitos, lo cual podría en algún momento atrapar alguno de los nanosistemas e impedir que entre a las células y la liberación del antioxidante sea menor (Jiang & Tuan, 2014).
La siguiente prueba TBARS, cuantifica malondialdehído (MDA) producto de lipoperoxidación mediada por radicales libres y estrés oxidante (Pérez et al., 2000).
Los anteriores resultados demuestran que el control positivo al exponerse a peróxido de hidrógeno incrementa sus niveles de MDA debido a la presencia de especies reactivas de oxígeno, lo que ocasiona la lipoperoxidación a nivel de la membrana celular, en cambio, para el control negativo y nanosistemas tanto cargados como vacíos los resultados podría apuntar a que su endocitosis, por lo menos la mayoría de las exposiciones no ocasionó daños significativos a la membrana celular que en contraste con la primera prueba corrobora el grado de toxicidad de los nanosistemas en el tejido (Frigaard et al., 2022).
Conclusión
- De acuerdo con los resultados anteriores, se demostró que ambos sistemas nanoestructurados presentaban respuestas similares con respecto a los biomarcadores de estado redox medido.
- Las características fisicoquímicas de los nanosistemas no afectaron al tejido posterior a su exposición según las pruebas de %EROs y TBARS, sin embargo, no se observaron diferencias entre los sistemas cargados y vacíos, lo cual sugiere que algún componente de la formulación podría estar interaccionando.
- El GSH medido durante la experimentación pudiera ser producto de la defensa antioxidante celular, así como el propio de los nanosistemas, por lo tanto, es necesaria realizar más pruebas que den certeza del origen del GSH cuantificado.
Agradecimientos
Para el proyecto PAPIIT-DGAPA con nombre “Estudio de la respuesta antioxidante inducida por nanopartículas de quitosán con glutatión en la osteoartrosis, estudio in vitro e in vivo” clave IN214321 por el apoyo para realizar el trabajo.
Referencias
Denzoin, V. L. A., Soraci, A. L., & Tapia, M. O. (2013). Homeostasis del glutatión. Acta Bioquímica Clínica Latinoamericana, 47(3), 529-539. ISSN: 0325-2957.
Forman, H. J., & Rinna, A. (2009). Glutathione: Overview of its protective roles, measurement, and biosynthesis. Molecular Aspects of Medicine, 30(1-2), 1-12. https://doi.org/10.1016/j.mam.2008.08.006
Frigaard, J., Jensen, J. L., Galtung, H. K., & Hiorth, M. (2022). The Potential of Chitosan in Nanomedicine: An Overview of the Cytotoxicity of Chitosan Based Nanoparticles. Frontiers in Pharmacology, 13. https://doi.org/10.3389/fphar.2022.880377
García, J. M. (2002). Introducción al cultivo de tejidos. http://histolii.ugr.es/jmgarcia/cultivos/cultivos.pdf
Jiang, Y., & Tuan, R. S. (2014). Origin and function of cartilage stem/progenitor cells in osteoarthritis. Nature Reviews Rheumatology, 11(4), 206-212. https://doi.org/10.1038/nrrheum.2014.200
Pérez, G. P. L. & Pérez, A. J. L. (2000). Métodos para medir el daño oxidativo. Revista Cubana de Medicina Militar, 29(3), 192-198.
Rizeq, B., Younes, N., Rasool, K., & Nasrallah, G. K. (2019). Synthesis, Bioapplications, and Toxicity Evaluation of Chitosan-Based Nanoparticles. International Journal of Molecular Sciences, 20(22), 5776. https://doi.org/10.3390/ijms20225776
Villafuerte, R., L., García, F. B., Garzón, S. M. L., Hernández, L. A, & Vázquez, R. M. L. (2008). Nanopartículas lipídicas sólidas. Revista Mexicana de Ciencias Farmacéuticas, 39(1), 38-52.
Sexto Congreso Nacional de Tecnología 18, 19 y 20 de octubre de 2023,
celebrado en formato virtual

D. R. © UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO.
Excepto donde se indique lo contrario esta obra está bajo una licencia Creative Commons Atribución No comercial, No derivada, 4.0 Internacional (CC BY NC ND 4.0 INTERNACIONAL).
https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es

ENTIDAD EDITORA
Facultad de Estudios Superiores Cuautitlán.
Av. Universidad 3000, Universidad Nacional Autónoma de México, C.U., Delegación Coyoacán, C.P. 04510, Ciudad de México.
FORMA SUGERIDA DE CITAR:
Hernández-Moncada, X., López-Barrera, L. D., Ramírez-Noguera, P., y Díaz-Torres, R. (2023). Estudio de la capacidad antioxidante de dos nanosistemas en cultivos organotípicos de cartílago de rata. MEMORIAS DEL CONGRESO NACIONAL DE TECNOLOGÍA (CONATEC), Año 6, No. 6, septiembre 2023 - agosto 2024. Facultad de Estudios Superiores Cuautitlán. UNAM. https://tecnicosacademicos.cuautitlan.unam.mx/CongresoTA/memorias2023/Mem2023_Paper21-EC.html