Inicio / Archivo / Año 5, No 5, septiembre 2022 - agosto 2023 / Paper 02

ESTUDIO DE LA ACTIVIDAD DE ENZIMAS ANTIOXIDANTES EN
CÉLULAS DE GLÁNDULA MAMARIA EXPUESTAS A
NANOPARTÍCULAS
Laura Denise López-Barrera, Roberto Díaz-Torres* y Patricia Ramírez-Noguera
Facultad de Estudios Superiores Cuautitlán, UNAM,
*diaztorres_r@cuautitlan.unam.mx
Resumen
El estrés oxidante se encuentra involucrado en diversas enfermedades, una de ellas el cáncer de mama, se ha visto que en esta patología el estado redox juega un papel importante para el progreso y desarrollo de la enfermedad y en etapas tardías está asociado al desarrollo de resistencia a quimioterapéuticos, por lo que se ha planteado el uso de sistemas de nanopartículas (NPs) para mejorar la respuesta. Por otro lado, el glutatión es el principal agente antioxidante y está relacionado con la respuesta temprana de la célula ha estímulos estresantes, de igual manera es utilizado por enzimas antioxidantes como un mecanismo para contrarrestar el estrés inducido. El objetivo es evaluar el efecto de la exposición de nanopartículas de quitosán con glutatión en la actividad de enzimas antioxidantes en células transformadas de glándula mamaria. Las nanopartículas fueron expuestas a las células MCF7 y MDA 231-MB para evaluar el efecto sobre la actividad de las enzimas glutatión peroxidasa, glutatión reductasa y catalasa. Los resultados mostraron que la exposición de las células a las NPs incrementó la actividad de enzimas como la glutatión peroxidasa y catalasa y reduce la actividad de la GRX enzima que está relacionada directamente con el contenido de glutatión de la célula, por otro lado, tratamientos combinados con el antineoplásico doxorrubicina mostraron un incremento potenciado de la actividad de estas enzimas. CONCLUSIÓN: De acuerdo con los resultados obtenidos la actividad de enzimas antioxidantes se ve modificada por la presencia de las nanopartículas de quitosán con glutatión, además de verse potenciada algunas veces por la exposición combinada con doxorrubicina. Esto podría ser de utilidad dado lo eventos celulares que pudieran verse modificados por las alteraciones del estado redox como la apoptosis y la proliferación celular.
Palabras clave:Quitosán, glutatión, redox, cáncer.
Introducción
El glutatión (GSH) es un tripéptido compuesto por los aminoácidos, glutamina, cisteína y glicina (γ-L-glutamil-L-cisteinil-glicina) y es uno de los principales mecanismos antioxidantes endógenos a nivel celular (Kalinina et al., 2014). El ciclo redox GSH/GSSG en el que participan las enzimas como el glutatión peroxidasa (GPx), glutatión reductasa (GRx) y catalasa permite que los niveles de GSH a nivel celular se mantengan en homeostasis. Los conjugados de GSH así como los niveles bajos de GSH o GSSG inducen la síntesis de novo GSH para mantener el estado redox celular (Corso y Acco, 2018). Un desequilibrio en el estado redox celular, se ha asociado a una gran cantidad de enfermedades en humanos y animales. Algunas son la artritis reumatoide, enfermedades neurodegenerativas, cataratas, síndromes metabólicos y diversos tipos de cáncer ( Dasgupta y Klein, 2014; Klaunig y Wang, 2018; Smallwood et al., 2018).
En este trabajo nos enfocamos en específico al cáncer de mama, el cual es uno de los principales problemas de salud a nivel mundial, ya que se estima que su incidencia es de un 11.6%, colocándolo entre los primeros tres tipos de cáncer diagnosticados en hombres y mujeres (Bray et al., 2018). Existen diversos fármacos que se pueden usar para su tratamiento, algunos de ellos como la Doxorrubicina y el Cisplatino, han mostrado tener efectos tóxicos a nivel renal y hepático, al generar acumulación de especies reactivas oxígeno y el subsecuente daño a nivel de tejido (Moo et al., 2018). El uso de nanotecnología en el tratamiento contra el cáncer representa un nuevo panorama, con la posibilidad de disminuir dichos efectos debido a las propiedades fisicoquímicas que pueden tener las nanopartículas (NPs) (Bose y Wong, 2015; Doello et al., 2015).
Objetivo
Evaluar el efecto de la exposición de nanopartículas de quitosán con glutatión en la actividad de enzimas antioxidantes en células transformadas de glándula mamaria.
Materiales y métodos
Fabricación de Nanopartículas de Quitosán cargadas con Glutatión
Las nanopartículas fueron preparadas por medio del método de gelación iónica como previamente se describió (López, 2019), resumiendo, se preparó una solución de quitosán al 0.3% y una solución de tripolifosfato de sodio (STPP) conteniendo 0.2 g de glutatión y se adicionó esta última solución gota a gota en la solución de quitosán.
Actividad de Catalasa
Cada sistema de la curva se prepara con una concentración conocida de catalasa en medio de reacción con tritón x-100 y se agrega una solución de H2O2 al 30%. Los sistemas se mezclan y se incuban a temperatura ambiente. Después de la reacción el O2 es atrapado por el tritón X-100 permitiendo la medición de la espuma formada en un tubo de 15 mm (Iwase et al., 2013).
Actividad de Glutatión Peroxidasa (GPx)
La actividad de la enzima GPx se realiza de acuerdo a lo descrito por Esworthy et al., 1999. La técnica se basa en la medición de la disminución de la absorción del NADPH, por una reacción acoplada de la GPx que utiliza el GSH para convertir el H2O2 en H2O. La producción de GSSG es utilizado por la GRx y se produce la conversión de NADPH a NADP. Para su lectura se utiliza una longitud de onda de 340 nm.
Actividad de Glutatión Reductasa (GRx)
La actividad de la enzima GRx se basa en el monitoreo del NADP en conjunto con la reducción del GSSG. Dado que el NADPH absorbe a 340 nm, su oxidación es reflejada por una disminución de la absorbancia a una temperatura de 30°C (Mannervik, 2004). Las células confluentes y en placas de 6 pozos se rasparon y colocaron en un buffer de lisis (PMSF, Tritón al 0.1 % y EDTA 5 mM), se determinó la cantidad de proteína total de acuerdo al método de Bradford y posteriormente se midió su actividad.
Diseño Experimental
Una de las líneas celulares utilizadas fue la MCF-7, esta línea celular es la más usada para estudiar el cáncer de mama, a pesar de ser originada de un tumor avanzado metastásico, la línea celular es no invasiva y representa un modelo experimental para estadios tempranos de la enfermedad, además de la presencia de receptor de estrógenos funcional y dependencia de estrógenos para su crecimiento (Welsh, 2013).
La otra línea celular utilizada fue la MDA MB-231, (línea proveniente de un carcinoma ductal invasivo) es usada comúnmente como un modelo para estudiar la etapa tardía del cáncer de mama, al ser similar al subtipo basal. Esta línea tiene el receptor de estrógenos, el receptor de progesterona y es E-cadherina negativo, además de presentar poca expresión o ausencia del factor de crecimiento HER2 (Welsh, 2013).
Para evaluar el efecto modulador de las NPs, una vez que las células se encontraban en un 50 % de confluencia se dividieron en dos grupos; 1) Células no tratadas (NT) y 2) Células expuestas a doxorrubicina (Dox) 5 µM (por un tiempo de exposición de 12 hrs). Transcurrido el tiempo las células fueron lavadas con PBS y expuestas a NPs Q-GSH y NPs Q durante 2 hrs en ambos grupos. Al finalizar el tiempo de exposición con las NPs células fueron lavadas con PBS y se realizaron los análisis correspondientes (Figura 1).
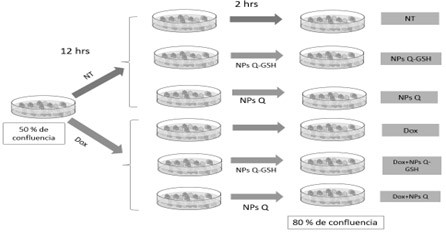
Figure 1. Diseño experimental, para evidenciar el efecto modulador de las Nanopartículas de Quitosán-Glutation (NPs Q-GSH).
Resultados y Discusión
Actividad especifica de Catalasa Como se observa en la Figura 2 la exposición de las NPs Q-GSH solo modificaron la actividad de las células MDA MB-231, mientras que en las células MCF-7 no hay diferencias respeto a las células NT. Sin embargo, cuando las células se exponen tanto a doxorrubicina como a NPs de Q-GSH la actividad se ve disminuida, comparada con la inducida por la doxorrubicina. Por un lado, el GSH proveniente de las NPs pudiera estar modificando como se observó anteriormente los niveles de especies reactivas de oxígeno (EROs), por lo cual la actividad de Catalasa se vería disminuida, mientras que con la exposición de NPs Q esta actividad se vio incrementada lo cual puede deberse a que se ha reportado en aislados de la enzima catalasa, que los grupos amino que están presentes en el quitosán pudieran facilitar la unión a la enzima de forma covalente, inmovilizándola o atrapándola modificando así su actividad (Kaushal, 2018; Inanan, 2019).
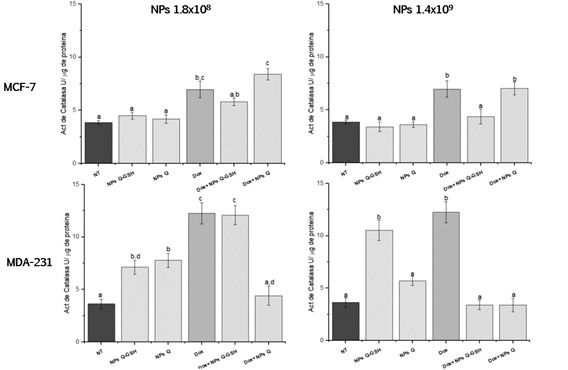
Figure 2. Actividad especifica de Catalasa. Letras iguales indican que no hay diferencias significativas entre las medias (Tukey <0.05)
Actividad especifica de Catalasa
Actividad de especifica de Glutatión Peroxidasa
La enzima Glutatión Peroxidasa (GPx) forma parte de los mecanismos antioxidantes intrínsecos a nivel celular. Esta enzima dependiente de selenio tiene como función llevar cabo la detoxificación del peróxido de hidrógeno y de hidroperóxidos formados de manera endógena. La GPx reduce los peróxidos mediante la utilización del GSH como agente reductor, el cual es oxidado y convertido en glutatión disulfuro (GSSG), para posteriormente ser regenerado por la enzima Glutatión reductasa (GRx) (Benhar, 2018). Para determinar la actividad de la GPx se utilizó el método descrito por R. S. Esworthy (Esworthy et al., 1999).
Como se observa en la Figura 3, la exposición de las NPs en las diferentes líneas celulares no modificó la actividad de esta enzima, salvo la concentración de 1.8x108 en las células MDA 231. Cuando las células son expuestas a doxorrubicina en combinación con NPs Q- GSH en las células MCF-7 la actividad se mantiene en niveles similares a esta y en el caso de las células MDA MB-231 los niveles disminuyen significativamente. Esto puede ser debido a la capacidad intrínseca de cada célula de reaccionar a la inducción de estrés generado por la exposición combinada de las NPs y la doxorrubicina como se ha mencionado con anterioridad.
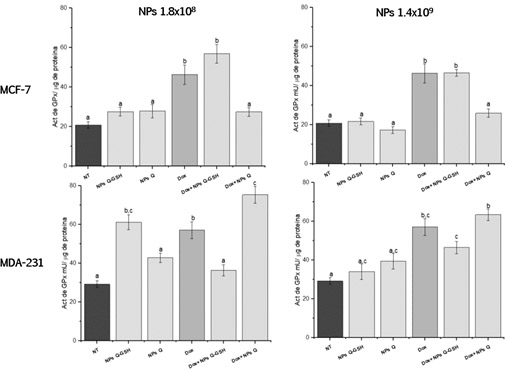
Figure 3. Actividad especifica de Glutatión Peroxidasa (GPx). Letras iguales indican que no hay diferencias significativas entre las medias (Tukey <0.05)
Actividad de especifica de Glutatión Reductasa (GRx) La Glutatión Reductasa (GRx), es una enzima constitutiva activa e inducible bajo estrés oxidativo (Couto, 2016). Se encarga de la regeneración del GSH a partir del GSSG en una reacción utilizando NADPH. Como se observa en la Figura 4, la exposición de las NPs Q-GSH en las dos concentraciones utilizadas y en las dos líneas celulares, no modifica los niveles de esta enzima, lo cual podría sugerir que no hay un estímulo inducible debido a un desequilibrio óxido-reducción a nivel celular debido a la exposición a las NPs. La exposición combinada tanto de doxorrubicina como de la exposición de NPs Q-GSH, así como las NPs Q disminuye significativamente la actividad de esta enzima. La actividad disminuyó probablemente debido a que las NPs mostraron capacidad para disminuir la cantidad de EROs a nivel celular, y al no haber un requerimiento por parte de la célula de la formación de GSH, disminuir la actividad de esta enzima que se encarga de regenerarlo.
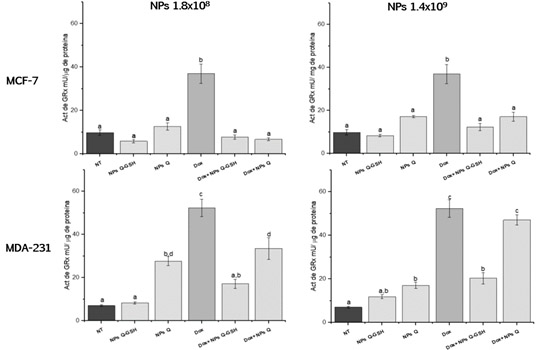
Figure 4. Actividad especifica de Glutatión Reductasa (GRx). Letras iguales indican que no hay diferencias significativas entre las medias (Tukey <0.05)
Conclusión
Las células MCF-7 mostraron mayor sensibilidad a la exposición con NPs que las células MDA MB 231, lo cual puede deberse a las propiedades propias de cada línea celular. De acuerdo con los resultados obtenidos la actividad de enzimas antioxidantes se ve modificada por la presencia de las nanopartículas de quitosán con glutatión, además de verse potenciada algunas veces por la exposición combinada con doxorrubicina. Esto podría ser de utilidad dado lo eventos celulares que pudieran verse modificados por las alteraciones del estado redox como la apoptosis y la proliferación celular.
Agradecimientos
Los autores agradecen el financiamiento de este trabajo a los proyectos PAPIIT IN214321 y a la cátedra de investigación CI2225.
Referencias
- Benhar, M. (2018). Free Radical Biology and Medicine Roles of mammalian glutathione peroxidase and thioredoxin reductase enzymes in the cellular response to nitrosative stress. Free Radical Biology and Medicine, 127: 160–164.
http://doi.org/10.1016/j.freeradbiomed.2018.01.028 - Bose, A., & Wong, W.T. (2015). Nanotechnology-Enabled Drug Delivery for Cancer Therapy. Nanotechnology Applications for Tissue Engineering. Elsevier Inc.
http://doi.org/10.1016/B978-0-323-32889-0.00011-X - Bradford, M. M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 72(1–2): 248-254.
http://doi.org/10.1016/0003-2697(76)90527-3 - Bray, F., Ferlay, J., & Soerjomataram, I., Siegel, L.R., Torre, A.L., & Jemail, A. (2018). Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. A Cancer Jorunal of Clinicians, 394–424.
http://doi.org/10.3322/caac.21492 - Corso, C. R., & Acco, A. (2018). Glutathione system in animal model of solid tumors: From regulation to therapeutic target. Critical Reviews in Oncology / Hematology, 128: 43–57.
http://doi.org/10.1016/j.critrevonc.2018.05.014 - Couto, N., Wood, J., & Barber, J. (2016). Free Radical Biology and Medicine The role of glutathione reductase and related enzymes on cellular redox homoeostasis network. Free Radical Biology and Medicine, 95: 27–42. http://doi.org/10.1016/j.freeradbiomed.2016.02.028
- Dasgupta, A., & Klein, K. (2014). Oxidative Stress Related to Other Diseases. Antioxidants in Food, Vitamins and Supplements. 185–207.
http://doi.org/10.1016/b978-0-12-405872-9.00011-2 - Doello, K., Cabeza, L., Ortiz, R., & Arias, J.L. (2015). Nanopartículas Magnéticas en el Diagnóstico y Tratamiento del Cáncer. Actual. Med., 100(796): 6–10.
http://doi.org/10.15568/am.2015.796.re01 - Esworthy, R.S., Chu, F.F., & Doroshow, J.H. (1999). Analysis of Glutathione-Related Enzymes. Current Protocols in Toxicology, 00(1): 7.1.1-7.1.32.
http://doi.org/10.1002/0471140856.tx0701s00 - Inanan, T. (2019). Chitosan Co -polymeric nanostructures for catalase immobilization. Reactive and Functional Polymers, 135: 94–102.
http://doi.org/10.1016/j.reactfunctpolym.2018.12.013 - Iwase, T., Tajima, A., Sugimoto, S., Okuda, K., Hironaka, I., Kamata, Y., & Mizunoe, Y. (2013). A Simple Assay for Measuring Catalase Activity: A Visual Approach. Scientific Reports, 3(1): 3081. http://doi.org/10.1038/srep03081
- Kalinina, E.V, Chernov, N.N., y Novichkova, M.D. (2014). Role of Glutathione, Glutathione Transferase, and Glutaredoxin in Regulation of Redox Dependent Processes, 79(13): 1562–1583.
- Kaushal, J., Seema, Singh, G., & Arya, S.K. (2018). Immobilization of catalase onto chitosan and chitosan–bentonite complex: A comparative study. Biotechnology Reports, 18: e00258.
https://doi.org/10.1016/j.btre.2018.e00258 - Klaunig, J.E., & Wang, Z. (2018). Oxidative stress in carcinogenesis. Current Opinion in Toxicology, 7: 116-121. http://doi.org/10.1016/j.cotox.2017.11.014
- López, B.L.D., Díaz, T.R., Ramírez, N.P., López, M.A., López, R.A.G. & Olmos, S. (2019). Oxidative stress modulation induced by chitosan-glutathione nanoparticles in chondrocytes. Die pharmazie. 74: 406-411.
- Mannervik, B. (2004). Measurement of Glutathione Reductase Activity. Current Protocols in Toxicology, 00(1): 7.2.1-7.2.4. http://doi.org/10.1002/0471140856.tx0702s00
- Moo, T.A., Sanford, R., Dang, C., & Morrow, M. (2018). Overview of Breast Cancer Therapy. PET Clinics, 13(3): 339-354. http://doi.org/10.1016/j.cpet.2018.02.006
- Smallwood, M.J., Nissim, A., Knight, A.R., Whiteman, M., Haigh, R., & Winyard, P.G. (2018). Oxidative stress in autoimmune rheumatic diseases. Free Radical Biology and Medicine, 125: 3-14.
http://doi.org/10.1016/j.freeradbiomed.2018.05.086 - Welsh, J.E. (2013). Animal Models for Studying Prevention and Treatment of Breast Cancer. Animal Models for the Study of Human Disease. Elsevier.
http://doi.org/10.1016/B978-0-12-415894-8.00040-3
Quinto Congreso Nacional de Tecnología 19, 20 y 21 de octubre de 2022,
celebrado en formato virtual

D. R. © UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO.
Excepto donde se indique lo contrario esta obra está bajo una licencia Creative Commons Atribución No comercial, No derivada, 4.0 Internacional (CC BY NC ND 4.0 INTERNACIONAL).
https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es

ENTIDAD EDITORA
Facultad de Estudios Superiores Cuautitlán.
Av. Universidad 3000, Universidad Nacional Autónoma de México, C.U., Delegación Coyoacán, C.P. 04510, Ciudad de México.
FORMA SUGERIDA DE CITAR:
López-Barrera, L. D., Díaz-Torres, R. y Ramírez-Noguera, P. (2022). Estudio de la actividad de enzimas antioxidantes en células de glándula mamaria expuestas a nanopartículas. MEMORIAS DEL CONGRESO NACIONAL DE TECNOLOGÍA (CONATEC), Año 5, No. 5, septiembre 2022 - agosto 2023. Facultad de Estudios Superiores Cuautitlán. UNAM. https://tecnicosacademicos.cuautitlan.unam.mx/CongresoTA/memorias2022/mem2022_ExtensoPaper2.html