Inicio / Archivo / Año 5, No 5, septiembre 2022 - agosto 2023 / Paper 06

EFECTO INMUNOLÓGICO-VASCULAR DE LA COMBINACIÓN CAPTOPRIL-HIDROCLOROTIAZIDA Y LOSARTÁN-HIDROCLOROTIAZIDA EN LA HIPERTENSIÓN ARTERIAL.
Víctor Daniel Farías-Sánchez*, Luis Antonio Pimentel-Cuevas, Diego Lezama-Martínez, Diego Armando Ramírez-Moreno.
Farmacología del Miocardio. Facultad de Estudios Superiores Cuautitlán-UNAM
*vdanielfarias98@gmail.com
Resumen
Es evidente la participación del sistema inmunológico (SI) en la hipertensión arterial (HTA), la idea se basa en infiltrados inmunitarios que promueven la inflamación aguda local que a largo plazo causan daño a órganos reguladores provocando un control deficiente de la presión arterial (PA). Se sabe qué fármacos antihipertensivos como Captopril, Losartán o Hidroclorotiazida poseen propiedades inmunomoduladoras; dicho lo anterior se caracterizaron los cambios que ocurren a nivel bioquímico e inmunológico encontrando su relación. Se manejaron 4 lotes con 6 ratas (WKY, SHR, SHR-Captopril-Hidroclorotiazida (C-H) y SHR-Losartán-Hidroclorotiazida (L-H)), evaluándose la PA; además de un conteo celular en frotis sanguíneo; los tejidos aórtico, mesentérico, esplénico y pulmonar fueron utilizados en la expresión relativa de genes (IL-1β, TNF-α, IL-10, TGF-β, ECA, ECA2) mediante qRT-PCR; se utilizó la aorta frente a angiotensina II, fenilefrina y acetilcolina para evaluar su respuesta. Los tratamientos provocaron una disminución de la PA, una alteración en el conteo celular; además existió una menor vasoconstricción del lote L-H a angiotensina II, para fenilefrina mostraron un comportamiento similar; mientras que para acetilcolina el lote Captopril-Hidroclorotiazida género mayor vasodilatación. En la qRT-PCR la expresión relativa de ARNm de TGF-β aumento para L-H, para TNF-α disminuyó en aorta en SHR. La expresión en ECA y ECA II aumento en bazo de WKY y en SHR disminuyó. La IL-10 aumento en los lotes con tratamiento. La terapia combinada disminuyó la PA, además de modificar las poblaciones leucocitarias y favorecieron la expresión de ARNm de citocinas antiinflamatorias.
Palabras clave:Sistema Renina-Angiotensina-Aldosterona, disfunción endotelial, estrés oxidativo, inmunomodulación.
Introducción
La PA corresponde a la tensión generada por la sangre dentro de arterias; cuando existe un aumento crónico que sobrepase los límites de PA sistólica (PAS) ≥ 140 mm Hg y PA diastólica (PAD) ≥ 90 mm Hg, se habla de una HTA; actualmente es una de las enfermedades más comunes que afectan la salud humana, siendo una de las causas principales de muerte prematura evitable en el mundo. Se estima que hay alrededor de 1,130 millones de personas con HTA y que de ellos las complicaciones a causa de esta enfermedad rondan las 9.4 millones de muertes anualmente. En México, se reportó una cifra de 15.2 millones de personas mayores a 20 años con diagnóstico previo de HTA manteniéndose entre las primeras causas de muerte en el país con alrededor del 20% de decesos reportados (Campos et al., 2018). Las razones por las cuales se desencadena la HTA obedecen a perturbaciones del sistema nervioso simpático (SNS) mediante la regulación de catecolaminas; la desregulación hormonal la cual origina un desequilibrio entre la liberación de sustancias vasoconstrictoras y vasodilatadoras, además de la propia predisposición genética y de factores ambientales, contribuyen a la elevación de la PA (Wagner, 2018). El bloqueo del Sistema Renina Angiotensina (SRAA) es claro, los fármacos de acción central que actúan sobre este sistema como los inhibidores de la enzima convertidora de angiotensina (IECA) o antagonistas de los receptores de la angiotensina II (ARA II) son eficaces como terapia de primera línea para la HTA, pero la combinación de fármacos con efectos directos en distintos sistemas fisiológicos tiene un mayor impacto sobre la PA que la monoterapia, ya que puede bloquear sus respuestas compensatorias (Lezama et al., 2021). Los tratamientos actuales que tienen como objetivo limitar la influencia del SRAA o SNS en fallan en el 40% de los casos, lo que sugiere que están involucrados otros mecanismos para la regulación de la PA. En los últimos años, se ha vuelto cada vez más evidente la participación del SI en la HTA, ya que es un proceso inflamatorio que implica la transmigración y acumulación de células del SI, innatas como adaptativas, en tejidos afectados, teniendo relevancia en su desarrollo y progresión; además del daño de órganos terminales principalmente a causa del estrés oxidativo generado por las especies reactivas de oxígeno (ROS) (Drummond et al., 2019). La desregulación del proceso inflamatorio puede ocurrir durante el principio de la HTA y su desarrollo de forma crónica, lo que se puede identificar a partir de biomarcadores como la expresión de citocinas pro y antiinflamatorias, la presencia de células en sangre, así como también la expresión de receptores presentes. El uso de fármacos antihipertensivos como IECA o ARA II tienen la capacidad de modificar la expresión de citocinas, inclusive la expresión de leucocitos y receptores alterando su porcentaje o disminuyendo su actividad.
Objetivo
Determinar el efecto de la terapia combinada con Captopril-Hidroclorotiazida y Losartán-Hidroclorotiazida mediante Curvas Concentración Respuesta y los niveles de citocinas en aorta, arteria mesentérica, pulmón y bazo por medio de qRT-PCR de modelos SHR para evaluar la reactividad vascular y su expresión relativa identificando la relación que existe entre el SI y el SRAA.
Materiales y métodos
Modelo Biológico: El modelo SHR (Spontaneously Hypertensive Rat) posee una HTA similar al del humano provista por diversos factores (neurales, hormonales, genéticos e inmunológicos) (Rivera et al., 2013). Se dividieron en 4 grupos experimentales (n=6): (1) control WKy tratado con vehículo (solución Tween 80 al 2%). (2) control SHR tratado con vehículo; (3) SHR Captopril-Hidroclorotiazida (10/6.6 mg/día) y SHR Losartán-Hidroclorotiazida (10/6.6 mg/día). La administración fue por vía oral durante 7 días.
Medición de PA: La medición de PA fue determinada por triplicado, mediante la técnica de Tail-Cuff, utilizando equipo SPAM (INC, México) basado en la detección de cambios del ión Fe2+ de la hemoglobina generado por la disminución en la obstrucción del flujo sanguíneo, los valores arrojados se analizaron con el software Sievart-1 antes y después de cada tratamiento (Rivera et al., 2013; Lezama et al., 2021).
Evaluación de Respuesta Vascular: Se sacrificaron los animales mediante la saturación con CO2, extirpándose la aorta torácica. El método permite identificar la modificación en la cantidad o sensibilidad de receptores del tejido a consecuencia de los antihipertensivos o por la etiología hipertensiva (Lezama et al., 2021). La aorta diseccionada libre de tejido conectivo se cortó en anillos de 3 mm; mismos que se montaron en cámaras adicionadas con Krebs manteniendo oxigenación, temperatura y pH fisiológico. Cada anillo se fijó a 2 ganchos que lo fijaron a la cámara y al transductor isométrico BIOPACTM-100 (BIOPAC, California: USA) el cual se conectó a un equipo de datos MP-100A-CE BIOPAC (BIOPAC, California: USA) con el software AcqKnowledge 3.8.1. obtuvimos la fuerza de contracción de los anillos a distintas concentraciones de angiotensina II (10-8 a 10-4 M), fenilefrina (10-8 a 10-4 M) y acetilcolina (10-10 a 10-4 M).
Conteo Celular: Se puncionó la zona ventricular tomando una muestra sanguínea en un tubo con EDTA, valorando la serie leucocitaria por medio del extendido sanguíneo ayudado de la tinción de Wright. Cada frotis fue examinado bajo el microscopio identificando cada población leucocitaria. El estudio proporcionó información básica del número de células sanguíneas de interés, cuya modificación se puede asociar al proceso inflamatorio causados por la HTA o para vigilar la respuesta fisiológica al tratamiento.
PCR: Con los tejidos aórtico, mesentérico, esplénico y pulmonar se extrajo el ARNm de cada tejido mediante TRIzol y por columna con el kit EZ-10 DNAaway miniprep. El siguiente paso consistió en convertir el ARNm a ADNc con la ayuda del kit Enhanced Avian First Strand Synthesis. El análisis de primers fue realizado a partir de la especie Rattus norvegicus para cada primer: TNF-α, IL-1β, IL-10, TGF-β y las enzimas ECA y ECA2 los cuales se adquirieron de Sigma-Aldrich Inc. La qRT-PCR se realizó con el kit Forget-Me-Not EvaGreen qPCR Máster Mix a una concentración a 10 μmol/L para el ADNc. Se realizó en 49 ciclos, con un inicio en 95 °C/5 min, seguido de ciclos a 95°C/10s, temperatura de hibridación (ECA: 58°C, ECA II: 56 °C, IL-1b: 64°C, IL-10: 57°C, TGF-b: 64°C, TNF-a: 59°C) /10s y 72 °C/10s, y una extensión a 72°C/10 min. La expresión relativa de ARNm se analizó utilizando el método −2 ΔΔCt (Flores et al. 2020).
Resultados
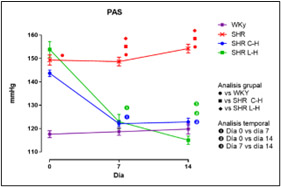
Figura 1. Valores de PAS en grupos WKy / SHR y SHR C-H / SHR L-H
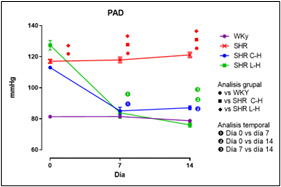
Figura 2. Valores de PAS en grupos WKy / SHR y SHR C-H / SHR L-H
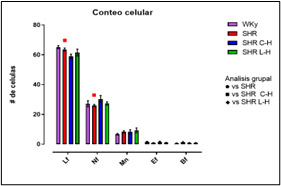
Figura 3. Conteo celular en grupos WKy / SHR y SHR C-H / SHR L-H
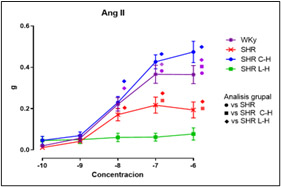
Figura 4. Valores de la concentración- respuesta acumulada a Angiotensina II.
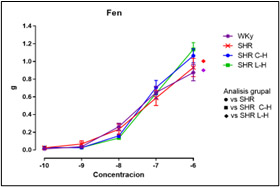
Figura 5. Valores de la concentración- respuesta acumulativa a Fenilefrina
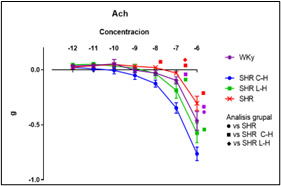
Figura 6. Valores de la concentración- respuesta acumulativa a Acetilcolina.
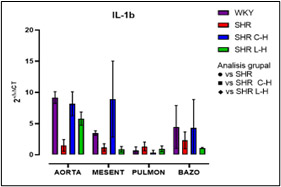
Figura 7. Expresión relativa de IL-1β después de cada tratamiento

Figura 8. Expresión relativa de TNF-α después de cada tratamiento
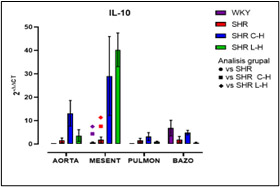
Figura 9. Expresión relativa de IL-10 después de cada tratamiento
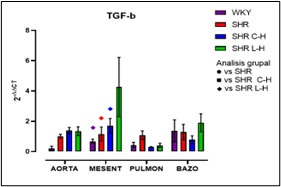
Figura 10. Expresión relativa de TGF-β después de cada tratamiento
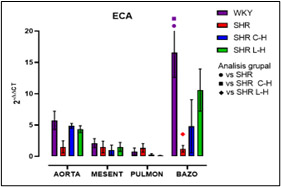
Figura 11. Expresión relativa de ECA después de cada tratamiento
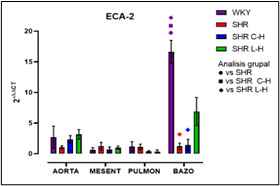
Figura 12. Expresión relativa de ECA-2 después de cada tratamiento
Dados los resultados en las Figuras 1 y 2 se muestra una reducción de la PA en ambos tratamientos comparado con el lote SHR; para la Figura 3 del conteo celular, el número de monocitos se encuentra aumentado en los lotes SHR y con antihipertensivos el número de neutrófilos tuvieron niveles más altos y en la población linfocitaria se observa un decremento en los lotes con tratamiento farmacológico. En la Figura 4 la Ang II el SHR presentó una menor respuesta, en cambio, el SHR C-H generó una mayor respuesta. La Figura 5 de Fenilefrina generó un comportamiento similar en todos los tratamientos y la Figura 6 de Acetilcolina el SHR L-H mostró una mayor respuesta vasodilatadora en comparación con el SHR. En las Figuras 7 y 8 de citocinas proinflamatorias no se muestra diferencia significativa para IL-1 β, en cambio, en TNF-α se ve un decremento en la expresión del lote SHR. En las Figuras 9 y 10 de citocinas antiinflamatorias se observa un incremento en ambos antihipertensivos para IL-10 y un aumento en el lote SHR L-H para TGF-β. Por último, en la Figura 11 los niveles en bazo aumentaron la expresión de ECA, y en la Figura 12 existe un aumento en la expresión de ECA2 en los lotes con tratamiento.
Discusión
Con la administración de cada combinación antihipertensiva se redujo la PA logrando tener un control; esta reducción es atribuida al mecanismo de acción de cada fármaco; el Captopril inhibe la acción de la ECA disminuyendo la producción de Ang II; mientras que el Losartán actúa bloqueando los receptores AT1 inhibiendo el efecto de Ang II y en específico, la Hidroclorotiazida inhibe los cotransportadores de Na+ y CI- favoreciendo que la elevación de la PA sea dependiente del SRAA obteniendo un efecto de suma en el tratamiento (Felkle et al., 2022). En cuanto al conteo celular, el número elevado de monocitos del SHR es atribuible al desajuste ocasionado por el estrés oxidativo sobre la vasculatura pues mediadores como ROS y DAMPs permiten la acumulación de macrófagos inflamatorios (M1) por medio de la expresión quimiocinas (CCL2) (Drummond et al., 2019). En el conteo celular de cada tratamiento, se puede sostener que modificaron el funcionamiento de los grupos leucocitarios; en este sentido, las combinaciones redujeron el reclutamiento de monocitos por diferentes mecanismos; siendo que para Captopril inhibe la expresión receptor quimiotáctico de quimiocinas CC tipo 9 y el Losartán induce un cambio de perfil en macrófagos hacia un fenotipo antiinflamatorio M2 por medio del receptor AT1 lo que también inhibe la actividad de NADPHoxidasa y producción de ROS. (Bryniarski et al., 2021; Felkle et al., 2022). En segundo lugar, el incremento de neutrófilos en el SHR es atribuible a cambios epigenéticos que facilitan la transcripción y expresión de factores proinflamatorios (Felkle et al., 2022); con lo que su reducción en ECA fue a consecuencia de la modificación en la expresión del receptor de TNF-α lo que conlleva una regulación negativa de moléculas de adhesión y señalización (ICAM-1 y E-selectina); asimismo el mecanismo de Losartán inhibe la expresión de receptores quimioatrayentes como el CCR2b y la producción local del ligando CXCL1 (Silveira et al., 2013; Bryniarski et al., 2021). Finalmente, en relación con la población linfocitaria se observa un decremento en los lotes con tratamiento farmacológico, debido al bloqueo de Ang II por el IECA inhibiendo el desarrollo de células autorreactivas Th1 y Th17. Por otra parte, los ARA II también reducen la maduración, la movilización y la actividad de los leucocitos como consecuencia del bloqueo en el aumento de la entrada de iones de Ca2+ resultando en la inhibición en la activación y proliferación de los linfocitos T (Lezama et al., 2017). Por otra parte, el desarrollo de curvas Concentración-Respuesta mostró la disfunción endotelial presente en el modelo SHR por la HTA; siendo que los tratamientos mejoraron esa respuesta a la vasoconstricción por Ang II y vasodilatación por Acetilcolina; para Fenilefrina se generó un comportamiento similar en todos los tratamientos debido a que el mecanismo de acción tanto del IECA como del ARA II no participan en la vía de contracción del MLV dependiente de receptores α1-adrenérgicos (Lezama et al., 2021). La reactividad vascular presente para Ang II con Losartán demostró una menor tensión en comparación con los demás lotes, atribuible al desequilibrio de receptores AT1 / AT2 con proporciones que favorecen condiciones hipotensoras por la expresión del receptor AT2 4; en cambio, Captopril al generar una mayor tensión; regula positivamente la expresión de la eNOS, al incrementar la vía de señalización del receptor B2 y la liberación de NO aumentando su biodisponibilidad (Lezama et al., 2021). Para la respuesta a acetilcolina Losartán fue mejor debido al estímulo ocasionado por el receptor AT2 que aumenta la liberación de NO, bradicinina y prostaglandinas (PGE2, PGI2) sin embargo Captopril por medio de la activación directa de receptores B2 de cininas mejora la biodisponibilidad de PGI2 y NO (Bryniarski et al., 2021). Finalmente, en la qRT-PCR se observó una mayor expresión relativa de IL-10 en vasos de resistencia para ambos tratamientos resultando favorecedor pues indica una inhibición en la síntesis de citocinas proinflamatorias, contrarrestar la proliferación y supervivencia de linfocitos Th1, disminuyendo el proceso inflamatorio. En la expresión de TGF-β aumento para el tratamiento de Losartán lo que marca el desarrollo de linfocitos T reguladores, pues esta citocina induce y regula la expresión de Foxp3 (Felkle et al., 2022). Por otro lado, ambos tratamientos no elevaron la expresión de ECA en comparación con el control normotenso, no obstante, el Captopril tuvo una tendencia a disminuir su expresión. En cuanto a la expresión de ECA 2 se vio perjudicada al verse reducida en bazo junto con su capacidad de sintetizar péptidos antiinflamatorios como Ang 1-7. Ambas combinaciones farmacológicas no modificaron la expresión de IL-1β, pero sí en la expresión de TNF-α, lo que favorece un proceso inflamatorio, sin embargo, no se sabe con certeza la cantidad de proteína sintetizada y sus niveles séricos por lo que sería importante su determinación. Estudios comparables demuestran que Captopril y Losartán actúan interfiriendo la activación del NF-kB por medio de la inducción de su inhibidor (IκB), teniendo un papel crucial en la regulación transcripcional de los genes inflamatorios citados en esta investigación (Wagner, 2018).
Conclusión
Apoyándonos de los resultados obtenidos en esta investigación quedó demostrado que ambos tratamientos tienen la capacidad de poseer potenciales efectos regulatorios en la respuesta vascular lo que redujo la disfunción endotelial a causa de ROS. Logro modificar las poblaciones leucocitarias; teniendo un impacto sobre su actividad tanto en circulación sistémica como en tejidos. Finalmente, la expresión relativa de citocinas tuvo una influencia por la aplicación de dichos tratamientos; lo cual permite la modificación del curso inflamatorio de la HTA. Podemos inferir que la terapia combinada de Captopril-Hidroclorotiazida resulta tener un mayor efecto modulador; no obstante, la terapia con Losartán-Hidroclorotiazida demostró tener efectos favorables contra los mecanismos patológicos de la HTA.
Agradecimientos
Al apoyo de los programas PAPIIT-IN217122, UNAM-FESC CI2259.
Referencias
- Bryniarski, P., Nazimek, K., & Marcinkiewicz, J. (2021). Captopril Combined with Furosemide or Hydrochlorothiazide Affects Macrophage Functions in Mouse Contact Hypersensitivity Response. International journal of molecular sciences, 23(1).
https://doi.org/10.3390/ijms23010074. - Campos, N.I., Hernández, B.L., Pedroza, T.A.,Medina, C., & Barquera, S. (2018). Hipertensión Arterial en adultos mexicanos: Prevalencia, Diagnóstico y Tipo de tratamiento. Ensanut MC 2016. Rev. Salud Pública México, 60(3).
https://doi.org/10.21149/8813. - Drummond, R.G, Vinh, A., Guzik, J.T., & Sobey, G.C. (2019). Immune mechanisms of hypertension. Nature Reviews Immunology, 19(1): 517-532.
https://doi.org/10.1038/s41577-019-0160-5. - Felkle, D., Jarczyński, M., Kaleta, K., Zieba, K., & Nazimek, K. (2022). The immunomodulatory effects of antihypertensive therapy: A review. Journal Biomedicine & Pharmacotherapy, 153(1).
https://doi.org/10.1016/j.biopha.2022.113287. - Flores, M.J., Lezama, M.D., Fonseca, C.S., & Martínez, A.L. (2020). Differences in the expression of the renin angiotensin system and the kallikrein-kinin system during the course of myocardial infarction in male and female Wistar rats. Journal of the Renin-Angiotensin Aldosterone System, 21(2): 1470320319900038.
https://doi.org/10.1177/1470320319900038. - Lezama, M.D., Hernández, C.M.E., Flores, M.J., Valencia, H.I., & Martínez, A.L. (2021). Time-Dependent Effects of Individual and Combined Treatments With Nebivolol, Lisinopril, and Valsartan on Blood Pressure and Vascular Reactivity to Angiotensin II and Norepinephrine. Journal of Cardiovascular Pharmacology and Therapeutics, 25(5): 490-499.
https://doi.org/10.1177/10742484211001861. - Lezama, M.D., Valencia, H.I., Flores, M.J., & Martínez, A.L. (2017). Combination of β Adrenergic Receptor Block and Renin-Angiotensin System Inhibition Diminished the Angiotensin II-Induced Vasoconstriction and Increased Bradykinin-Induced Vasodilation in Hypertension. Dose-Response. 15(4): 1559325817737932.
https://doi.org/10.1177/1559325817737932. - Rivera, C., Hernández R. & Marin, H. (2013). Manejo reproductivo de la colonia de Rata Espontáneamente Hipertensa (SHR) y su control Normotenso Wistar Kyoto (WKY) en el bioterio del Instituto de Fisiología Celular de la Universidad Nacional Autónoma de México. Rev. Electrónica de Veterinaria, 14 (11B).
- Silveira, K.D., Coelho, F.M., Vieira, A.T., Barroso, L.C., Queiroz, J.C.M., Costa, V.V., Soussa, L.F.C., Oliveira, M.L., Bader, M., Silva, T.A., Santos, R.A.S., Simoes, E.S.A.C., & Teixeira, M.M. (2013). Mechanisms of the anti-inflammatory actions of the angiotensin type 1 receptor antagonist losartan in experimental models of arthritis. Journal Peptides. 46(1): 53-63.
https://doi.org/10.1016/j.peptides.2013.05.012. - Wagner, G.P. (2018). Pathophysiology of hypertension: New concepts. Revista Peruana de Ginecología y Obstetricia, 64(2): 175-184.
https://doi.org/10.31403/rpgo.v64i2075
Quinto Congreso Nacional de Tecnología 19, 20 y 21 de octubre de 2022,
celebrado en formato virtual

D. R. © UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO.
Excepto donde se indique lo contrario esta obra está bajo una licencia Creative Commons Atribución No comercial, No derivada, 4.0 Internacional (CC BY NC ND 4.0 INTERNACIONAL).
https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es

ENTIDAD EDITORA
Facultad de Estudios Superiores Cuautitlán.
Av. Universidad 3000, Universidad Nacional Autónoma de México, C.U., Delegación Coyoacán, C.P. 04510, Ciudad de México.
FORMA SUGERIDA DE CITAR:
Farías-Sánchez, V. D., Pimentel-Cuevas, L. A., Lezama-Martínez, D., y Ramírez-Moreno, D. A. (2022). Efecto inmunológico-vascular de la combinación captopril-hidroclorotiazida y losartán-hidroclorotiazida en la hipertensión arterial. MEMORIAS DEL CONGRESO NACIONAL DE TECNOLOGÍA (CONATEC), Año 5, No. 5, septiembre 2022 - agosto 2023. Facultad de Estudios Superiores Cuautitlán. UNAM. https://tecnicosacademicos.cuautitlan.unam.mx/CongresoTA/memorias2022/mem2022_ExtensoPaper6.html