Inicio / Archivo / Año 4, No 4, septiembre 2021 - agosto 2022 / Paper 01

SÍNTESIS DE UN NUEVO POLÍMERO BIODEGRADABLE A PARTIR DE
LA COPOLIMERIZACIÓN DE ALGINATO DE SODIO/ACRILATO DE ETILO
María de los Angeles Cornejo-Villegas*y Alicia Del Real-López
Departamento de Ingeniería y Tecnología, FES-Cuautitlán, Laboratorio de Procesos de Transformación y Tecnologías Emergentes de Alimentos, Universidad Nacional Autónoma de México, Cuautitlán Izcalli, Estado de México C.P. 54714, México.
*angiecornejo@unam.mx
Resumen
El objetivo del estudio fue obtener un nuevo polímero a partir de alginato de sodio y acrilato de etilo (AlgNa/EA) injertado biodegradable, empleando dos procesos químicos: primero, una reacción de transesterificación entre la sal del ácido carboxílico y el éster del acrilato de etilo (EA), seguida de la polimerización del grupo vinilo del monómero de acrilato de etilo (EA) vía, radicales libres. El análisis de Infrarrojo por transformada de Fourier (FTIR) del copolímero (AlgNa/EA) muestra una ausencia de las bandas de etilo, mientras que se mantiene la banda característica de la piranosa, lo que confirma el injerto del monómero. El análisis termogravimétrico (TGA) muestra que el alginato de sodio (AlgNa) tuvo tres temperaturas de descomposición: 103 °C debida a la deshidratación, 212 °C asociada a la destrucción de los enlaces glicosídicos y 426 °C debida a la conversión del alginato (AlgNa) en Na2CO3. El copolímero (AlgNa/EA) presenta cuatro procesos a diferentes temperaturas: evaporación del alcohol OH a 65 °C, descomposición del alginato (AlgNa) no injertado a 220 oC, descomposición del copolímero (AlgNa/EA) a 298 °C y finalmente la degradación de los fragmentos en carbonato Na2CO3 a 423 °C. Asimismo, la evaluación microbiológica de la acción del crecimiento fúngico sobre el copolímero (AlgNa/EA) fue superior al 50%, lo que significa que es un excelente material para ser biodegradado
Palabras clave: alginato de sodio; copolimerización de injerto; polímero biodegradable
Introducción
Los polisacáridos son polímeros naturales biodegradables formados por monosacáridos unidos por enlaces glucosídicos (Nessi et al., 2019). Algunos como el almidón, la celulosa, el glucógeno, el ácido algínico, el agar carragenina, quitosano, goma xantana, dextrano, pectina entre otros (Barclay et al., 2019). Las modificaciones resultan de la mezcla de polisacáridos con polímeros sintéticos que modifican sus propiedades funcionales, con la polimerización in situ de un monómero dando lugar a redes interpenetradas (RI), o el injerto de un monómero en la cadena del polisacárido con su posterior polimerización, dando lugar a la reticulación por injerto.
El alginato de sodio es un polisacárido lineal derivado del ácido algínico compuesto por 1,4-β-d ácido manurónico (M) α-1 ácido gulurónico (G) (Agüero et al., 2017). El alginato tiene grupos hidroxilo y carboxilo libres distribuidos a lo largo de la cadena principal; Estos dos grupos funcionales pueden modificarse químicamente, como la oxidación, la sulfatación, la esterificación o el injerto (Yang & He, 2012).
Los hidrogeles pueden sintetizarse a partir de alginato de sodio con polímeros o copolímeros acrílicos y con otros compuestos como la acrilamida para crear una red interpenetrante (RI) entre los polímeros basada en fenómenos electrostáticos (Laurienzo et al., 2006). Además, hay investigaciones en las que se realiza una polimerización de alginato de sodio (SA) y un monómero acrílico utilizando, en la mayoría de los casos, un reticulante como la N, N-metilen-bis-acrilamida (MBAA) o dimetacrilato de etilenglicol (EGDMA); para obtener hidrogeles con diferentes aplicaciones (Khalid et al., 2018). En una investigación con acrilato de etilo para sintetizar un copolímero de injerto con alginato de sodio se utilizó nitrato de amonio cérico como iniciador (Shah et al., 1995).
Objetivo
Obtener un nuevo polímero de injerto biodegradable realizando dos procesos químicos: primero, una reacción de transesterificación entre la sal del ácido carboxílico y del éster de acrilato de etilo, seguida de la polimerización por radicales libres del grupo vinilo del monómero de acrilato de etilo (AE), y como iniciador, α,α,′-Azoisobutironitrilo; (AIBN) y sin agente de reticulación para la polimerización.
Metodología
Síntesis del copolímero: alginato de sodio (polimanuronato de sodio) (Golden Bell® CA, USA) grado USP, acrilato de etilo (EA; Sigma-Aldrich, St. Louis, MO, USA), iniciador α,α,′-Azoisobutironitrilo (AIBN; Sigma-Aldrich, St. Louis, MO, USA) con una pureza del 98%.
Pruebas de biodegradación: agar papa dextrosa (DPA BD Bioxon, México), agar bacteriológico (BD Bioxon, México), citrato trisódico pentahidratado (Merck, México), fosfato potásico anhidro monofásico (Merck, México), fosfato de potasio monobásico anhidro (J,T, Baker, USA), sulfato de cobre (II) pentahidratado (Sigma-Aldrich, USA), sulfato de manganeso monohidratado, ácido ortobórico anhidro (JT Baker, USA), cloroformo (Sigma-Aldrich, USA.), sulfato de magnesio heptahidratado (Merck), sacarosa (Sigma-Aldrich, USA.) y glicerol al 99,5% de pureza (Sigma-Aldrich, USA.). Para la biodegradación se utilizó el hongo Alternaria spp. aislado en el laboratorio.
Síntesis Copolímero preparación del copolímero de poli-injerto (AlgNa/AE), se disolvieron 7,5 g de alginato de sodio (SA) en 300 mL de agua destilada a 95 °C con agitación mecánica durante 3 h, llevar a temperatura ambiente. Después, se disolvieron 5 g de acrilato de etilo (PEA) con agitación mecánica, y la solución se llevó a una temperatura de 75 °C; se burbujeó nitrógeno para eliminar el oxígeno disuelto, y luego se añadieron 0,040 g de iniciador AIBN. La polimerización se llevó a cabo durante 6 h. El material polimerizado se lavó tres veces con acetona para eliminar el homopolímero residual y precipitar el copolímero. El precipitado se re-disolvió en agua y se secó en una caja de Petri, obteniéndose una película de un grosor de 0,125 ± 0,003 mm. se presentan los resultados del mejor injerto. Para tener un parámetro de comparación, se sintetizó poli(acrilato de etilo) (PEA) en las mismas condiciones que para el copolímero en ausencia de alginato de sodio (AlgNa).
Caracterización Copolímero
Espectroscopia FTIR Las películas de Poliacrilato de etilo (PEA), AlgNa y poli(AlgNa/AE) se analizaron en un espectrómetro Bruker vector 33 ATR-FTIR Bruker Spectrometer I18500 PS15 Billerica, MA, USA, Power Sup-ply 115/230 V en el rango de 4000 a 400 cm-1; para cada prueba se aplicaron 32 escaneos con suavizado. Con esta técnica se determinaron los grupos funcionales de cada compuesto, así como la vibración del grupo que forma el enlace de injerto.
Análisis termogravimétricos (TGA) Los análisis termogravimétricos se llevaron a cabo para determinar la pérdida de masa en cada transición térmica, la descomposición del copolímero y la estabilidad térmica de cada compuesto, en un TA Instruments Q5000IR TGA MS rango de temperatura ambiente a 1200 ̊C, New Castle, DE, USA, Thermal Analysis System series. Las muestras de aproximadamente 5 mg se sometieron a calentamiento de 25 a 600 °C a una velocidad de 10 °C/min bajo una atmósfera de nitrógeno.
Evaluación de la acción de un microorganismo del biodeterioro de los plásticos. Los ensayos de deterioro de las películas de injerto se realizaron en medio sólido, utilizando el método de la pantalla de la caja de Petri y el método descrito en la norma UNE-EN ISO 846:1997, "Evaluación de la acción de los microorganismos" (International Standard, 2019). Esta técnica utiliza la inspección visual para evaluar la labilidad al ataque de los hongos, se asigna los valores: 0 ningún crecimiento aparente bajo el microscopio; 1 ningún crecimiento visible a simple vista, pero visible bajo el microscopio; 2 crecimiento visible a simple vista, que cubre el 25% de la muestra; 3 crecimiento visible a simple vista, hasta el 50% de la superficie de prueba; 4 crecimiento considerable, que cubre más del 50% de la superficie de prueba; y 5 crecimiento que cubre toda la superficie de prueba (International Standard, 2019). Las películas de copolímero de 1 X 1 cm2 esterilizadas por UV que se inoculó con el hongo Alternaria spp. en una de las esquinas de la película se colocaron en las cámaras de humedad ≥ 95% a 30 °C durante dos meses. Los resultados se observaron semanalmente con el microscopio electrónico de barrido JEOL-JSM-6060LV Tokio, Japón, a un voltaje de 20 KV.
Resultados
El análisis FTIR se utilizó para investigar las interacciones moleculares (Figura 1) muestra las estructuras moleculares entre AlgNa, PEA y poli(AlgNa/EA), la Tabla 1 resume las asignaciones de las bandas de absorción de estos materiales.
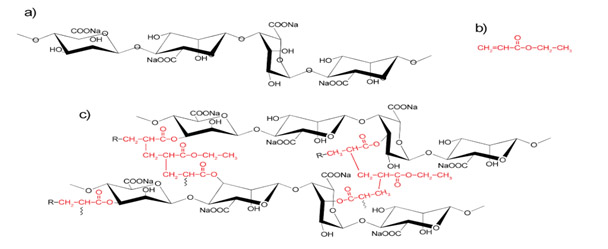
Figura 1. Estructuras químicas de (a) AlgNa, (b) PEA, y (c) poli(AlgNa/AE).


Análisis termogravimétrico muestra las temperaturas en la que el copolímero manifiesta las transformaciones más relevantes. La Figura 2 muestra las curvas de TGA y TGA diferencial (DTG) de (a) PEA, (b) AlgNa, y (c) poli(AlgNa/EA). Se observa en la figura 3a, del termograma de la PEA una etapa de descomposición a 400 °C con una pérdida de peso del 96%, lo que implica la degradación total del polímero (Pérez y Monleón, 2017).
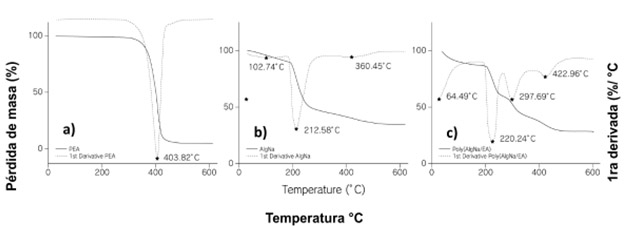
Figure 2. TGA thermogramas de (a) PEA, (b) AlgNa, and (c) poly(AlgNa/EA) pérdida de masa en (%) vs. temperatura y primera derivada del peso (%) e identificación de los cambios presentes en cada gráfico
Evaluación de la acción de un microorganismo del biodeterioro de los plásticos.
En la Figura 3 se observa el deterioro de las películas por Alternaria spp y se determinó por medio de la observación de hifas, esporas y conidios en el microscopio electrónico de barrido.

Figura 3. Imágenes SEM del crecimiento de los hongos sobre la película de poli(AlgNa/EA) a 20X, 300X y 1000X en función del tiempo en semanas.
Discusión
La Tabla 1 para el compuesto PEA muestra las características de vibración del enlace C-H del grupo etilo: el estiramiento simétrico CH3 se sitúa en 2979 cm-1, el estiramiento asimétrico CH3 se sitúa en 2964 cm-1, y el estiramiento asimétrico CH2 del éster etílico se sitúa en 2937 cm-1. Las bandas de 1469 cm-1, 1446 cm-1, 1379 cm-1, 1332 cm-1, 852 cm-1 y 761 cm-1 se atribuyen al estiramiento asimétrico del CH2, al estiramiento asimétrico del CH3, al estiramiento asimétrico del CH3, a la torsión del CH2, al estiramiento del C-C y al balanceo del CH2 de los grupos etílicos, respectivamente (Socrates, 2002); estas bandas no se encuentran en el poli(AlgNa/EA), y su ausencia se atribuye a la transesterificación, en la que se pierden los grupos etílicos de la PEA. La presencia de la señal situada a 2190 cm-1 corresponde al triple enlace del grupo nitrilo C-N del iniciador AIBN que se ancla a la cadena durante la polimerización.
En la Figura 2b, el termograma para AlgNa muestra tres efectos termogravimétricos, siendo el primero una pérdida de masa del 10% a 103 °C debido a la deshidratación pérdida de agua unida por puentes de hidrógeno (adsorbida). La energía de enlace entre las moléculas de agua y los sitios de sorción es mayor que la energía que mantienen las moléculas de agua pura (Park et al., 2007). La segunda pérdida de peso de alrededor del 41% se observó a 212 °C; esta pérdida de peso se asocia típicamente con la destrucción de los enlaces glicosídicos (Liu et al., 2005) y corresponde a la fragmentación del alginato debido a la rotura de la cadena. El último efecto termogravimétrico se produjo a 426 °C con una pérdida de peso del 12,4%, donde los fragmentos y unidades monoméricas del alginato se convierten en Na2CO3 (Liu et al., 2005; Soares et al., 2004).
En la Figura 2c, poli(AlgNa/EA) se observan cuatro procesos térmicos, a 65 °C se produce la evaporación de una mezcla de alcohol (generada en la transesterificación) y agua (unida al alginato) con una pérdida de peso del 13%, a 220 °C se atribuye a la descomposición del alginato de sodio, con una pérdida de peso del 25%. A 298 °C, se atribuye a la descomposición del copolímero, con una pérdida de peso del 16%. Por lo tanto, se confirma que la síntesis de copolimerización de injerto entre el alginato y el acrilato de etilo tiene una mayor estabilidad térmica que el polisacárido no modificado. Por último, el pico presente a 423 °C con una pérdida de peso del 18% se atribuye a la degradación de los fragmentos y a la conversión de la unidad monomérica en carbonato. (Liu et al., 2005; Soares et al., 2004).
La Figura 3 muestra una imagen SEM del crecimiento del hongo Alternaria spp. sobre la película de copolímero de poli(AlgNa/EA) en función del tiempo; el crecimiento del hongo sobre las membranas de polímero se inspeccionó cada semana durante dos meses (12 semanas). En la Figura 3, sólo se muestran las semanas 1, 2, 3 y 12 del estudio porque los cambios de biodeterioro observados en esas semanas se consideraron más representativos.
En la primera semana, se detectó que el hongo fue incubado satisfactoriamente; se inició su crecimiento y se observa cómo las hifas están ancladas o adheridas a la película. En la segunda semana, se observó el aumento del número de hifas en las películas, que se identifican con una mejor definición de su estructura, atribuida al tiempo de incubación. En la tercera semana, la cantidad del hongo ha aumentado debido a la acción enzimática que se estaba generando entre el hongo y la película de copolímero se muestra las hifas completamente maduras y con una mejor definición que en las semanas anteriores. Finalmente, en la semana 12 la imagen de SEM muestra que la película del copolímero ha sido invadida por la Alternaria spp. Como resultado, el hongo ha madurado a expensas de los nutrientes del copolímero; esto es indicativo de la degradación de la película de plástico. El crecimiento de los hongos en la superficie era superior al 50%, lo que significa que es un material excelente para ser degradado.
Conclusión
Un nuevo material injertado transesterificado proveniente del EA y PEA se obtuvo con un crecimiento microbiano en la superficie de la película mayor al 50% de acuerdo con la norma ISO 846 (International Standard, 2019), lo que significa que es un excelente material para ser biodegradado, este novedoso material desarrollado Poli(AlgNa/EA) es amigable con el medio ambiente.
Referencias
- Agüero, L., Zaldivar, S.D., Peña, L., Dias, M. (2017). Alginate microparticles as oral colon drug delivery device: A review. Carbohydrate Polymers, 168: 32-43.
https://doi.org/10.1016/j.carbpol.2017.03.033 - Barclay, T.G., Day, C.M., Petrovsky, N., Garg, S. (2019). Review of polysaccharide particle-based functional drug delivery. Carbohydrate Polymers, 221: 94-112.
https://doi.org/10.1016/j.carbpol.2019.05.067 - International Standard. (2019). Plastics - Evaluation of the action of microorganisms Plastiques. International Standard, ISO 846:20(03), 36.
- Khalid, I., Ahmad, M., Usman, M.M., Barkat, K., Sohail, M. (2018). Cross-Linked Sodium Alginate-g-poly(Acrylic Acid) Structure: A Potential Hydrogel Network for Controlled Delivery of Loxoprofen Sodium. Advances in Polymer Technology, 37(4): 985–995.
https://doi.org/10.1002/adv.21747 - Laurienzo, P., Malinconico, M., Mattia, G., Russo, R., Rotonda, M.I. La, Quaglia, F., Capitani, D., Mannina, L. (2006). Novel alginate–acrylic polymers as a platform for drug delivery. Journal of Biomedical Materials Research Part A, 78A(3): 523–531.
https://doi.org/10.1002/jbm.a.30763 - Liu, Y., Li, Y., Yang, L., Liu, Y., Bai, L. (2005). Graft copolymerization of methyl acrylate onto sodium alginate initiated by potassium diperiodatocuprate (III). Iranian Polymer Journal, 14(5): 457-463.
- Nessi, V., Falourd, X., Maigret, J.E., Cahier, K., D’Orlando, A., Descamps, N., Gaucher, V., Chevigny, C., Lourdin, D. (2019). Cellulose nanocrystals-starch nanocomposites produced by extrusion: Structure and behavior in physiological conditions. Carbohydrate Polymers, 225: 115123.
https://doi.org/10.1016/j.carbpol.2019.115123 - Park, S., Venditti, R. A., Jameel, H., Pawlak, J.J. (2007). Studies of the heat of vaporization of water associated with cellulose fibers characterized by thermal analysis. Cellulose, 14(3): 195–204.
https://doi.org/10.1007/s10570-007-9108-1 - Pérez, G.M., Monleón, P.M. (2017). Poly(methacrylated hyaluronan-co-ethyl acrylate) copolymer networks with tunable properties and enzymatic degradation. Polymer Degradation and Stability, 144: 241-250.
https://doi.org/10.1016/j.polymdegradstab.2017.08.025 - Shah, S.B., Patel, C.P., Trivedi, H.C. (1995). Ceric-induced grafting of acrylate monomers onto sodium alginate. Carbohydrate Polymers, 26(1): 61-67.
https://doi.org/10.1016/0144-8617(95)98836-6 - Soares, J.P., Santos, J.E., Chierice, G.O., Cavalheiro, E.T.G. (2004). Thermal behavior of alginic acid and its sodium salt. Ecletica Quimica, 29(2): 57-63.
https://doi.org/10.1590/s0100-46702004000200009 - Socrates, G. (2002). Infrared and Raman characteristic group frequencies : tables and charts (3rd ed.). John Wiley & Sons.
- Yang, J., He, W. (2012). Synthesis of lauryl grafted sodium alginate and optimization of the reaction conditions. International Journal of Biological Macromolecules, 50(2): 428-431.
https://doi.org/10.1016/j.ijbiomac.2011.12.027
Cuarto Congreso Nacional de Tecnología 24, 25 y 26 de noviembre de 2021,
celebrado en formato virtual

D. R. © UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO.
Excepto donde se indique lo contrario esta obra está bajo una licencia Creative Commons Atribución No comercial, No derivada, 4.0 Internacional (CC BY NC ND 4.0 INTERNACIONAL).
https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es

ENTIDAD EDITORA
Facultad de Estudios Superiores Cuautitlán.
Av. Universidad 3000, Universidad Nacional Autónoma de México, C.U., Delegación Coyoacán, C.P. 04510, Ciudad de México.
FORMA SUGERIDA DE CITAR:
Cornejo-Villegas, M. A., y Del Real-López, A. (2021). Síntesis de un nuevo polímero biodegradable a partir de la copolimerización de alginato de sodio/acrilato de etilo. MEMORIAS DEL CONGRESO NACIONAL DE TECNOLOGÍA (CONATEC), Año 4, No. 4, septiembre 2021 - agosto 2022. Facultad de Estudios Superiores Cuautitlán. UNAM
https://tecnicosacademicos.cuautitlan.unam.mx/CongresoTA/memorias2021/mem2021_paper1.html