Inicio / Archivo / Año 7, No 7, septiembre 2024 - agosto 2025 / Paper 04

MODIFICACIÓN DE LA LIPOPEROXIDACIÓN INDUCIDA POR
ARSENIATO DE SODIO POR USO DE NANOPARTICULAS
ANTIOXIDANTES
ARSENIATO DE SODIO POR USO DE NANOPARTICULAS
ANTIOXIDANTES
Laura D López-Barrera1, Viridiana García-García1, Joselo R. Martínez-Rosas1, Roberto Díaz-Torres1 y Patricia Ramírez-Noguera1*
1 Laboratorio 9 “Toxicología Celular” UIM, Facultad de Estudios Superiores Cuautitlán, Universidad Nacional Autónoma de México
*ramireznoguera@unam.mx
Resumen
Los sistemas nanoparticulados pueden utilizarse para modificar las vías de señalización relacionadas con los efectos tóxicos de xenobióticos y, por lo tanto, con su toxicidad, mediante la adición de compuestos que modifiquen el estado óxido - reducción como el glutatión (GSH). El objetivo de este trabajo fue evaluar la capacidad antioxidante de nanopartículas de quitosán-glutatión (NPs-GSH) para modificar la lipoperoxidación inducida por el arseniato de sodio, utilizando un cultivo primario de condrocitos de rata, como modelo de osteoartritis. Las NPs-GSH fueron caracterizadas en tamaño (205.4 nm ± 33.35), potencial zeta (25.6 mV), y porcentaje de GSH (99.97%). Para determinar si se modificaba la toxicidad del arseniato de sodio, se expusieron los condrocitos a dos concentraciones de nanopartículas (0.08 y 0.64 µM de GSH) durante dos horas, seguidas de una exposición aguda al arseniato de sodio de dos horas a una concentración de 1x10⁻⁶ M, y se realizaron las determinaciones asociadas al estado redox. De acuerdo con los resultados obtenidos, el tamaño y el potencial zeta podrían favorecer la vectorización de las nanopartículas. En cuanto a la medición de biomarcadores, se observó un incremento en los niveles de GSH, que puede ser tanto el sintetizado por la célula como el aportado por las NPs-GSH. En presencia de un agente oxidante como el arseniato de sodio y una exposición posterior con NPs, se observó una reducción de los niveles de malondialdehído, lo que evidencia una disminución de la lipoperoxidación. Por último, la actividad de la enzima glutatión peroxidasa se incrementó significativamente respecto a las células no tratadas, lo cual puede estar asociado a que el GSH es su sustrato y, por lo tanto, favorecer la activación de esta enzima. Esto sugiere que las NPs-GSH disminuyen el efecto tóxico inducido por la exposición a este xenobiótico.
Palabras clave:Lipoperoxidación, GSH, nanopartículas, arseniato, estrés oxidante, condrocitos
Introducción
En los últimos años, se propuso el uso de sistemas nanoparticulados, que demostraron mejorar la respuesta en comparación con las formas farmacéuticas tradicionales debido a su tamaño y características particulares. Estos sistemas no solo disminuyeron los signos y síntomas, sino que también modificaron las vías de señalización asociadas con el progreso y desarrollo de enfermedades. Las nanopartículas son los sistemas más desarrollados en la nanotecnología. Se considera una nanopartícula a aquella partícula o entidad discreta que tenía una longitud entre 1 y 1000 nm en al menos una de sus dimensiones (Mendelson, 2013).
El glutatión (L-g-glutamil-L-cisteinil-glicina) es un tripéptido hidrosoluble formado por los aminoácidos glutamato, cisteína y glicina, siendo un antioxidante celular esencial presente en todos los órganos y tejidos, especialmente en el hígado, donde se encontraron las mayores concentraciones. La síntesis de GSH ocurrió solo en el citoplasma y, una vez liberado, no pudo reincorporarse a la célula (Franco, 2009).
El glutatión se encuentra en concentraciones promedio de 12 mM en células de mamíferos y tiene importantes funciones antioxidantes, participaba en la inhibición enzimática, reducción de EROS, inactivación de xenobióticos, control de la permeabilidad de la membrana, transporte de aminoácidos, y actuaba como coenzima. Además, interviene en el proceso de apoptosis, síntesis de proteínas, ADN y ARN, y regula la formación y mantenimiento de la forma activa de ciertas enzimas. Una de las funciones más importantes del glutatión es mantener el potencial de óxido-reducción de la célula, lo que permite la generación de diversas cascadas de señalización intracelular (Martínez, 2006). Por otro lado, el arsénico inhibe la actividad enzimática, y su toxicidad variaba según la forma química en que se presenta. Se cree que el arseniato (As (V)) daña la célula al competir con el fosfato inorgánico y formar un éster de arseniato inestable, lo que puede interferir en la producción normal de ATP y afectar el metabolismo celular (Olmos, 2018). Por ello, contar con un sistema que disminuye su toxicidad podría ser de gran utilidad.
Objetivo
Evaluar la capacidad antioxidante del glutatión presente en nanopartículas de quitosán-glutatión (NPs-GSH) para modificar los niveles de malondialdehído inducido por la exposición a arseniato, utilizando como modelo el cultivo primario de condrocitos de rata, expuestos a arseniato, a través de la medición de biomarcadores del estado redox.
Materiales y métodos
Preparación de las nanopartículas
Las nanopartículas de quitosán-glutatión (NPs-GSH) se prepararon por el método de gelación iónica, de acuerdo con lo descrito por López Barrera (2019) y posteriormente fueron caracterizados en tamaño de partícula, potencial Z, y % de GSH. La determinación del tamaño de partícula y el potencial Z de las NP’s se realizó con el equipo Nanosizer NANO – ZS90, Serie MAL1109355 a una temperatura de 25°C, a través del software Zetasiser. Las nanopartículas se ultracentrifugaron a 27 000 rpm por 1 h. Posteriormente se separa el sobrenadante y se hace reaccionar con el reactivo de Ellman para medir de manera indirecta la concentración de glutatión no encapsulado.
Cultivo celular
Se realizó el cultivo primario de condrocitos a partir de una muestra de cartílago obtenida de una rata Wistar hembra de 3 a 4 semanas de edad proveniente del bioterio de la Facultad de Estudios Superiores Cuautitlán-UNAM; la utilización de animales de experimentación para este ensayo fue aprobada por el Comité Institucional para el Cuidado y Uso de Animales de Experimentación de la Facultad de Estudios Superiores Cuautitlán con clave UNAM CICUAE-FESC C 23_30. La muestra de cartílago fue homogenizada mecánicamente y tratada con colagenasa para degradar la matriz extracelular, las células obtenidas fueron centrifugadas y el pellet resultante fue suspendido en medio DMEM/F12 e incubado a 37 °C, CO2 al 5% y humedad relativa a 90%.
Desafío con las nanopartículas
Para determinar si se modificaba la toxicidad del arseniato de sodio se expusieron los condrocitos a dos concentraciones de nanopartículas (0.08 y 0.64 µM de GSH) por dos horas, posteriormente a 2 horas al arseniato de sodio a una concentración de 1x10-6 M y se realizaron las determinaciones asociadas al estado redox.
Niveles de GSH
La determinación de los niveles de GHS extracelular se realizó mediante el ensayo de DTNB (ácido 2,2-dithiobisnitrobenzoico) o reactivo de Elman, el cual reacciona con el grupo tiol del glutatión para producir TNB (5-thio-2-nitrobenzoato), un compuesto amarillo que puede ser leído a una longitud de onda de 450nm, en donde la cantidad de TNB producido es proporcional a la cantidad de glutatión presente en la muestra (Hu, 1994).
TBARs
Para evaluar la lipoperoxidación se realizó el ensayo de TBARS el cual mide los productos de oxidación de lípidos a nivel de membrana principalmente el malondialdehído el cual que interacciona con el ácido tiobarbitúrico generando un aducto color rosa (Céspedes, 2008). A una longitud de onda de 540 nm.
Actividad de la glutatión peroxidasa (GPx)
La actividad de GPx se evaluó según lo descrito en la literatura (Esworthy,1999), basado en la reducción de la absorbancia a 340nm del NADPH debido a una reacción acoplada con la glutatión reductasa (GRx), en donde un incremento en la actividad de GPx se observa con una disminucion en la absorbancia a una longitud de onda de 340nm
Análisis estadístico
Los datos fueron analizados usando un análisis de varianza (ANOVA) de una vía seguido de una comparación múltiple de medias de acuerdo con la prueba estadística Fisher. Considerando una diferencia significativa de p ˂0.05 a través del programa Origin lab 2024.
Resultados
Tabla 1. Tamaño de partícula y potencial Z de las NP’s, así como el promedio del porcentaje de encapsulación de GSH en las NP’S Q – GSH.
Sistema |
Tamaño |
Potencial Z |
% de |
|---|---|---|---|
Las NPs-GSH |
205.4/+-33.35 |
25.6 |
99.97 |
Las NPs-Q |
174.4+/-94.07 |
20.8 |
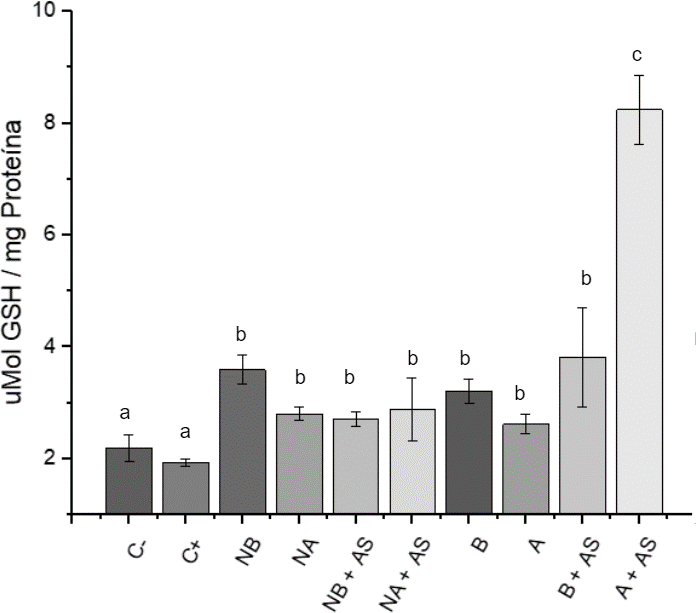
Figura 1. Niveles de glutatión intracelular
Notas: Las barras con letras diferente indican diferencias significativas entre las medias (Fisher p<0.5)
- C- células no tratadas C+ arseniato de sodio (As)
- NB: Nanopartículas a concentración baja (0.08 μM de GSH)
- NA: Nanopartículas a concentración alta (0.64 μM de GSH)
- A y B: Nanopartículas de Quitosán equivalentes a las NP’s cargadas a concentraciones altas y bajas de GSH
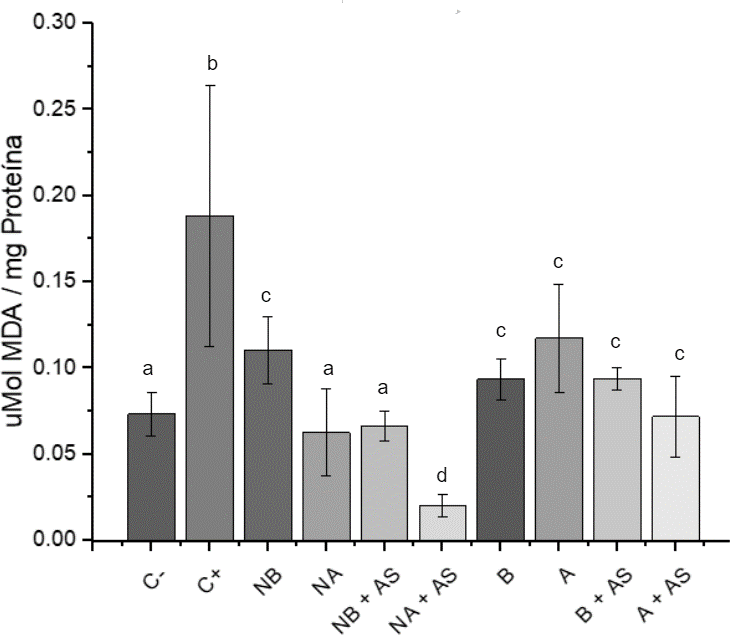
Figura 2. Niveles de lipoperoxidación.
Notas: Las barras con letras diferente indican diferencias significativas entre las medias (Fisher p<0.5)
- C- células no tratadas C+ arseniato de sodio (As)
- NB: Nanopartículas a concentración baja (0.08 μM de GSH)
- NA: Nanopartículas a concentración alta (0.64 μM de GSH)
- A y B: NPs de Quitosán equivalentes a las NPs cargadas a concentraciones altas y bajas de GSH
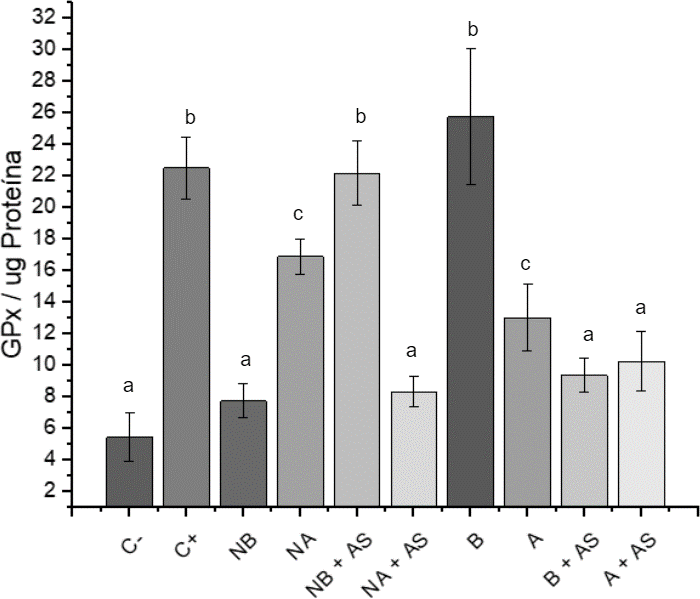
Figura 3. Actividad de la Glutatión Peroxidasa.
Notas: Las barras con letras diferente indican diferencias significativas entre las medias (Fisher p<0.5)
- C- células no tratadas C+ arseniato de sodio (As)
- NB: Nanopartículas a concentración baja (0.08 μM de GSH)
- NA: Nanopartículas a concentración alta (0.64 μM de GSH)
- A y B: NPs de Quitosán equivalentes a las NPs cargadas a concentraciones altas y bajas de GSH
Discusión
Para la elaboración de las NPs-GSH, se empleó el método de gelación iónica, donde la gelificación del quitosán ocurrió por interacciones electrostáticas con los grupos disociados del tripolifosfato de sodio en solución acuosa (Gooycolea, 2009). Se trabajó a un pH de 4.1 para mantener la solubilidad del quitosán y evitar la oxidación del glutatión (Romero, 2020). La caracterización de las NPs se realizó utilizando el equipo Nanosizer NANO – ZS90, basado en la dispersión de luz dinámica para analizar el tamaño de partícula y el potencial zeta, mostrando que las nanopartículas tenían un tamaño óptimo para atravesar barreras fisiológicas mediante endocitosis (Díaz, 2016).
El incremento del glutatión intracelular en presencia de NPs podría deberse a la respuesta celular ante estímulos externos, como la presencia de las nanopartículas, que activan la síntesis de GSH (Denzoin, 2013). El quitosán también mostró actividad antioxidante y biocompatibilidad, aumentando los niveles de glutatión en las células (Zahra, 2019).
Se observó que las NPs de concentración alta mantenían los niveles de MDA similares a los de las células no tratadas, sugiriendo una reducción del daño lipoperoxidativo, posiblemente debido a la presencia de glutatión proporcionado por las NPs. La actividad de la GPx se incrementó en presencia de NPs, posiblemente por la activación del factor de transcripción nuclear eritroide 2 asociado a factor 2 (Nrf2), el cual regula la respuesta celular contra agentes tóxicos y oxidantes, sugiriendo que las NPs podrían inducir la activación de sistemas antioxidantes celulares (Osamu, 2020); sin embargo, se requerirían estudios adicionales para confirmar la implicación de Nrf2 y otros mecanismos antioxidantes.
Conclusión
Las nanopartículas de quitosán con glutatión (NPs-GSH), elaboradas mediante gelificación iónica y caracterizadas por dispersión de luz dinámica, mostraron un tamaño y potencial Z óptimos para una suspensión estable, capaces de encapsular GSH sin causar citotoxicidad en condrocitos. Estas nanopartículas pudieron atravesar la membrana celular y liberar GSH. Se comprobó que el arseniato de sodio induce estrés oxidante, pero las NPs-GSH a 0.64 μM redujeron la lipoperoxidación y aumentaron la actividad de la enzima antioxidante GPx. Aunque las NPs Q también mostraron propiedades antioxidantes, se recomienda realizar más pruebas para obtener datos más específicos sobre su eficacia.
Agradecimientos
Al proyecto interno de cátedras de investigación 2024 con clave CI2476 “Estudio de la actividad toxicológica y terapéutica de agentes xenobióticos”.
Referencias
- Díaz, T.R., López, A.R., Escobar, C.J.J., García, G.E., Domínguez, D.L., Ramírez, N.P. (2015). Effect of Size and Functionalization of Pharmaceutical Nanoparticles and Their Interaction with Biological Systems. In: Aliofkhazraei, M. (eds) Handbook of Nanoparticles. Springer, Cham. https://doi.org/10.1007/978-3-319-13188-7_46-1
- Denzoin, V.L.A., Soraci, A.L., Tapia, M.O. (2013). Homeostasis del glutatión. Acta bioquímica clínica latinoamericana, 47(3): 529-539.
- Franco, R., Cidlowski, J.A. (2009). Apoptosis and glutathione: beyond an antioxidant. Cell Death &Differentiation, 16(10): 1303-1314. https://doi.org/10.1038/cdd.2009.107
- López, B.L.D., Díaz, T.R., Macay, A.L., López, R.A.G., Olmos, S.P., Ramírez, N.P. (2019). Oxidative stress modulation induced by chitosan-glutathione nanoparticles in chondrocytes. Die Pharmazie-An International Journal of Pharmaceutical Sciences, 74(7): 406-411. https://doi.org/10.1691/ph.2019.8166
- Martínez, S.M., Barrado, D.A., Zubillaga, M., Hager, A., De Paoli, T., Boccio, J. (2006). Conceptos actuales del metabolismo del glutatión Utilización de los isótopos estables para la evaluación de su homeostasis. Acta bioquímica clínica latinoamericana, 40(1): 45-54.
- Mendelson, M.I. (2013). Learning Bio-micro-nanotechnology. Vol. 176. New York: CRC Press.
- Olmos, V., Ridolfi, A.S. (2018). Hidroarsenicismo: mecanismos de acción asociados a la toxicidad del arsénico. Acta toxicológica argentina, 26(1): 32-44.
- Wada, H.O. (2020). Nrf2 and oxidative stress. In Preedy,V. (ed) Pathology. 77-86.
- Romero, S.A., Pereira, J. (2020). Estado del arte: Quitosano, un biomaterial versátil. Estado del Arte desde su obtención a sus múltiples aplicaciones. Revista Ingeniería UC, 27(2): 118-135.
- Hu, M.L. (1994). Measurement of protein thiol groups and glutathione in plasma. In Methods in enzymology, 233: 380-385).
- Esworthy, R.S., Chu, F.F., Doroshow, J.H. (1999). Analysis of glutathione‐related enzymes. Current Protocols in Toxicology, (1): 7-1.
Séptimo Congreso Nacional de Tecnología 16,
17 y 18 de octubre de 2024,
celebrado en formato virtual

D. R. © UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO
Excepto donde se indique lo contrario esta obra está bajo una licencia Creative Commons
Atribución No comercial, No derivada, 4.0 Internacional (CC BY NC ND 4.0
INTERNACIONAL).
https://creativecommons.org/licenses/by-nc-nd/4.0/deed.es

ENTIDAD EDITORA
Facultad de Estudios Superiores Cuautitlán.
Av. Universidad 3000, Universidad Nacional Autónoma de México, C.U., Delegación Coyoacán, C.P. 04510, Ciudad de México.
FORMA SUGERIDA DE CITAR:
López-Barrera, L. D., García-García, V., Martínez-Rosas, J. R., Díaz-Torres, R., y Ramírez-Noguera, P. (2024). MODIFICACIÓN DE LA LIPOPEROXIDACIÓN INDUCIDA POR ARSENIATO DE SODIO POR USO DE NANOPARTICULAS ANTIOXIDANTES. MEMORIAS DEL CONGRESO NACIONAL DE TECNOLOGÍA (CONATEC), Año 7, No. 7, septiembre 2024 - agosto 2025. Facultad de Estudios Superiores Cuautitlán. UNAM https://tecnicosacademicos.cuautitlan.unam.mx/CongresoTA/memorias2024/Mem2024_Paper04.html